Una pila de limón es una pila sencilla que suele fabricarse con fines educativos. Normalmente, se insertan en un limón un trozo de metal de cinc (como un clavo galvanizado ) y un trozo de cobre (como una moneda de un centavo) y se conectan mediante cables. La energía generada por la reacción de los metales se utiliza para alimentar un dispositivo pequeño, como un diodo emisor de luz (LED).
La pila de limón es similar a la primera pila eléctrica inventada en 1800 por Alessandro Volta , que utilizaba salmuera (agua salada) en lugar de zumo de limón. [1] La pila de limón ilustra el tipo de reacción química ( oxidación-reducción ) que se produce en las pilas. [2] [3] [4] El zinc y el cobre se denominan electrodos , y el zumo del interior del limón se denomina electrolito . Hay muchas variaciones de la pila de limón que utilizan diferentes frutas (o líquidos) como electrolitos y otros metales distintos del zinc y el cobre como electrodos.
Existen numerosos conjuntos de instrucciones para fabricar baterías de limón y para obtener componentes como diodos emisores de luz (LED), medidores eléctricos ( multímetros ) y clavos y tornillos recubiertos de zinc ( galvanizados ). [5] [6] Los kits científicos comerciales de "reloj de patata" incluyen electrodos y un reloj digital de bajo voltaje. Después de ensamblar una celda, se puede usar un multímetro para medir el voltaje o la corriente eléctrica de la celda voltaica; un voltaje típico es 0,9 V con limones. Las corrientes son más variables, pero varían hasta aproximadamente 1 mA (cuanto mayor sea la superficie de los electrodos, mayor será la corriente). Para un efecto más visible, las celdas de limón se pueden conectar en serie para alimentar un LED (ver ilustración) u otros dispositivos. La conexión en serie aumenta el voltaje disponible para los dispositivos. Swartling y Morgan han publicado una lista de dispositivos de bajo voltaje junto con el número correspondiente de celdas de limón que se necesitaban para alimentarlos; incluían LED, zumbadores piezoeléctricos y pequeños relojes digitales. Con los electrodos de zinc/cobre, se necesitaban al menos dos pilas de limón para cualquiera de estos dispositivos. [7] Sustituir un electrodo de magnesio por el electrodo de zinc crea una pila con un voltaje mayor (1,5−1,6 V), y una sola pila de magnesio/cobre alimentará algunos dispositivos. [7] Tenga en cuenta que no se utilizan bombillas incandescentes de linternas porque la batería de limón no está diseñada para producir suficiente corriente eléctrica para encenderlas. Una batería de este tipo normalmente produce 0,001 A (1 mA) de corriente a una diferencia de potencial de 0,7 V; estos valores se multiplican para determinar la potencia total de 0,0007 W (0,7 mW).

Se pueden utilizar muchas frutas y líquidos para el electrolito ácido. La fruta es conveniente porque proporciona tanto el electrolito como una forma sencilla de sujetar los electrodos. El ácido presente en las frutas cítricas (limones, naranjas, pomelos, etc.) es el ácido cítrico . La acidez, que se indica mediante el pH medido , varía sustancialmente.
Las patatas tienen ácido fosfórico y funcionan bien; son la base de los kits comerciales de "relojes de patata". [8] [9] Se ha propuesto el uso de baterías de patata con iluminación LED en países pobres o en poblaciones que no tienen acceso a la red eléctrica. Una investigación internacional iniciada en 2010 demostró que hervir patatas durante ocho minutos mejora su producción eléctrica, al igual que colocar rodajas de patata entre varias placas de cobre y zinc. La médula de plátano (tallo) hervida y picada también es adecuada, según investigadores de Sri Lanka. [10]
En lugar de fruta, se pueden utilizar líquidos en diversos recipientes. El vinagre doméstico ( ácido acético ) funciona bien. [11] El chucrut ( ácido láctico ) apareció en un episodio del programa de televisión estadounidense Head Rush (una derivación del programa MythBusters ). El chucrut había sido enlatado y se convirtió en el electrolito, mientras que la lata en sí era uno de los electrodos. [12]
Los electrodos de zinc y cobre son relativamente seguros y fáciles de obtener. También se pueden estudiar otros metales como el plomo, el hierro, el magnesio, etc., que producen voltajes diferentes a los del par zinc/cobre. En particular, los electrodos de magnesio/cobre pueden generar voltajes de hasta 1,6 V en las pilas de limón. Este voltaje es mayor que el que se obtiene utilizando pilas de zinc/cobre. Es comparable al de las baterías domésticas estándar (1,5 V), lo que resulta útil para alimentar dispositivos con una sola pila en lugar de utilizar pilas en serie. [7]
Para los alumnos más pequeños, de entre 5 y 9 años, el objetivo educativo es utilitario: [13] las baterías son dispositivos que pueden alimentar otros dispositivos, siempre que estén conectados mediante un material conductor. Las baterías son componentes de circuitos eléctricos; conectar un solo cable entre una batería y una bombilla no alimentará la bombilla.
En el caso de los niños de 10 a 13 años, las pilas se utilizan para ilustrar la relación entre la química y la electricidad, así como para profundizar en el concepto de circuito eléctrico. El hecho de que se utilicen diferentes elementos químicos, como el cobre y el cinc, se puede situar en el contexto más amplio de que los elementos no desaparecen ni se descomponen cuando experimentan reacciones químicas.
Para los alumnos mayores y para los estudiantes universitarios, las pilas sirven para ilustrar los principios de las reacciones de oxidación-reducción. [13] [14] Los estudiantes pueden descubrir que dos electrodos idénticos no producen voltaje y que diferentes pares de metales (más allá del cobre y el cinc) producen voltajes diferentes. Se pueden examinar los voltajes y las corrientes de las combinaciones en serie y en paralelo de las pilas. [15]
La corriente que emite la batería a través de un medidor dependerá del tamaño de los electrodos, de qué tan lejos se inserten los electrodos en la fruta y de qué tan cerca se coloquen los electrodos entre sí; el voltaje es bastante independiente de estos detalles de los electrodos. [16]
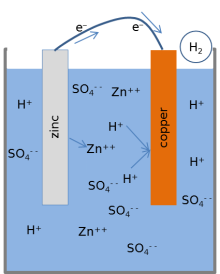
La mayoría de los libros de texto presentan el siguiente modelo para las reacciones químicas de una batería de limón. [1] [3] [17] Cuando la celda proporciona una corriente eléctrica a través de un circuito externo, el zinc metálico en la superficie del electrodo de zinc se disuelve en la solución. Los átomos de zinc se disuelven en el electrolito líquido como iones cargados eléctricamente (Zn 2+ ), dejando 2 electrones cargados negativamente (e − ) en el metal:
Esta reacción se llama oxidación . Mientras el zinc ingresa al electrolito, dos iones de hidrógeno con carga positiva (H + ) del electrolito se combinan con dos electrones en la superficie del electrodo de cobre y forman una molécula de hidrógeno sin carga (H2 ) :
Esta reacción se llama reducción. Los electrones utilizados en el cobre para formar las moléculas de hidrógeno se transfieren desde el zinc a través de un cable externo que conecta el cobre y el zinc. Las moléculas de hidrógeno formadas en la superficie del cobre por la reacción de reducción finalmente se evaporan en forma de gas hidrógeno.
Este modelo de las reacciones químicas hace varias predicciones que fueron examinadas en experimentos publicados por Jerry Goodisman en 2001. Goodisman señala que numerosos autores recientes proponen reacciones químicas para la batería de limón que implican la disolución del electrodo de cobre en el electrolito. Goodisman excluye esta reacción por ser incompatible con los experimentos y señala que la química correcta, que implica la evolución de hidrógeno en el electrodo de cobre pero también puede utilizar plata en lugar de cobre, se conoce desde hace muchos años. [4] La mayoría de las predicciones detalladas del modelo se aplican al voltaje de la batería que se mide directamente con un medidor en circuito abierto (no hay nada más conectado a la batería). Cuando se modificó el electrolito añadiendo sulfato de zinc (ZnSO 4 ), el voltaje de la celda se redujo como se predijo utilizando la ecuación de Nernst para el modelo. La ecuación de Nernst dice esencialmente cuánto cae el voltaje a medida que se añade más sulfato de zinc. La adición de sulfato de cobre (CuSO 4 ) no afectó al voltaje. Este resultado es consistente con el hecho de que los átomos de cobre del electrodo no están involucrados en el modelo de reacción química de la celda.
Cuando la batería está conectada a un circuito externo y fluye una corriente eléctrica significativa, el electrodo de zinc pierde masa, como se predijo por la reacción de oxidación del zinc anterior. De manera similar, el gas hidrógeno se desprende en forma de burbujas del electrodo de cobre. Finalmente, el voltaje de la celda dependía de la acidez del electrolito, medida por su pH; la disminución de la acidez (y el aumento del pH) hace que el voltaje caiga. Este efecto también se predice mediante la ecuación de Nernst; el ácido particular que se utilizó (cítrico, clorhídrico, sulfúrico, etc.) no afecta el voltaje excepto a través del valor del pH.
La predicción de la ecuación de Nernst falló en el caso de electrolitos fuertemente ácidos (pH < 3,4), cuando el electrodo de cinc se disuelve en el electrolito incluso cuando la batería no suministra corriente a un circuito. Las dos reacciones de oxidación-reducción mencionadas anteriormente solo ocurren cuando la carga eléctrica puede transportarse a través del circuito externo. La reacción adicional de circuito abierto se puede observar por la formación de burbujas en el electrodo de cinc en circuito abierto. Este efecto finalmente limitó el voltaje de las celdas a 1,0 V cerca de la temperatura ambiente en los niveles más altos de acidez.
La energía proviene del cambio químico que se produce en el zinc cuando se disuelve en el ácido. La energía no proviene del limón ni de la patata. El zinc se oxida dentro del limón, intercambiando algunos de sus electrones con el ácido para alcanzar un estado de menor energía, y la energía liberada proporciona la energía. [4]
En la práctica actual, el zinc se produce mediante la extracción electrolítica de sulfato de zinc o mediante la reducción pirometalúrgica del zinc con carbono, lo que requiere un aporte de energía. La energía producida en la batería de limón proviene de la inversión de esta reacción, recuperando parte de la energía aportada durante la producción de zinc.
Desde 1840 hasta finales del siglo XIX, las grandes celdas voltaicas que utilizaban un electrodo de zinc y un electrolito de ácido sulfúrico se utilizaron ampliamente en la industria de la impresión. Si bien a veces se usaban electrodos de cobre como los de las baterías de limón, en 1840 Alfred Smee inventó una versión refinada de esta celda que usaba plata con un revestimiento de platino rugoso en lugar de un electrodo de cobre. [18] [19] El gas hidrógeno adherido a la superficie de un electrodo de plata o cobre reduce la corriente eléctrica que se puede extraer de una celda; el fenómeno se llama "polarización". [17] [20] La superficie rugosa, "platinizada", acelera el burbujeo del gas hidrógeno y aumenta la corriente de la celda. A diferencia del electrodo de zinc, los electrodos de cobre o plata platinizada no se consumen al usar la batería, y los detalles de este electrodo no afectan el voltaje de la celda. La celda de Smee era conveniente para la electrotipificación , que producía placas de cobre para la impresión tipográfica de periódicos y libros, y también estatuas y otros objetos metálicos. [19] [21] [22] [23] [24]
La celda de Smee utilizaba zinc amalgamado en lugar de zinc puro; la superficie del zinc amalgamado ha sido tratada con mercurio . [23] Aparentemente, el zinc amalgamado era menos propenso a degradarse por una solución ácida que el zinc puro. [25] Los electrodos de zinc amalgamado y de zinc simple dan esencialmente el mismo voltaje cuando el zinc es puro. [26] Con el zinc imperfectamente refinado en los laboratorios del siglo XIX, generalmente daban diferentes voltajes. [25]
Antiguamente, una batería galvánica era una máquina estupenda y cara que ocupaba un gran espacio y costaba una suma considerable mantenerla en su corta vida útil. Ahora, se puede fabricar un instrumento mucho más potente en una caja de rapé y llevarlo en el bolsillo. Estas observaciones nos las imponen las asombrosas baterías de platino del señor Grove y las baterías químico-mecánicas inventadas por el señor Smee...
La primera mejora real sobre la celda de zinc-cobre simple en ácido se debió al Dr. Alfred Smee, quien notó que el gas hidrógeno liberado en la placa negativa se desprendía de ella mucho más fácilmente, por lo tanto, la polarización se producía mucho menos rápidamente si la superficie de esta placa era rugosa en lugar de ser completamente lisa; y el medio que encontró más eficiente fue el de recubrir la hoja o las hojas de plata con platino finamente dividido ...
Se puede realizar una modificación muy importante de la aplicación de esta pila, convirtiéndola en una
batería
de ácido , análoga a la plata platinizada del Sr. Smee. Quienes conocen el ingenioso dispositivo de ese caballero saben que la característica de su dispositivo es que la placa negativa, donde se libera el hidrógeno, se desprenderá de este hidrógeno muy fácilmente. En circunstancias normales, el hidrógeno se adhiere mucho a las placas de una batería de ácido y hace que una parte considerable de las placas queden fuera de acción, por su presencia en sus superficies. Para remediar esto, ha, como él lo llama, "platinizado" las superficies.
En 1840, Smee inventó una batería que hizo posible la electrotipia comercialmente. ... Tal vez uno de los mayores avances en relación con la electrotipia se produjo cuando se inventó la dinamo de galvanoplastia. La primera adopción de una dinamo, en lugar de la batería tipo Smee, fue por Leslie, de Nueva York, en 1872.Manual para aprendices de la industria gráfica. Breve introducción a la historia de la electrotipia.
La celda de Smee es la celda más comúnmente empleada debido a su extrema simplicidad de construcción y manejo.Una discusión detallada de la construcción y mantenimiento de las celdas de Smee, c. 1874.
, como los "bronces" que adornan la Ópera de París y la estatua de 320 cm de altura del Príncipe Alberto y cuatro figuras que lo acompañan, erigida detrás del Albert Hall de Londres como monumento a la Gran Exposición de 1851.
La singular propiedad que posee el zinc amalgamado de no ser atacado por el ácido sulfúrico diluido con agua se debe a la adhesión del hidrógeno sobre la placa en la solución ácida.