Borrelia burgdorferi es una especie bacteriana gramnegativa [1] de la clase de las espiroquetas del género Borrelia , y es uno de los agentes causantes de la enfermedad de Lyme en humanos. [2] [3] Junto con algunas genoespecies similares, algunas de las cuales también causan la enfermedad de Lyme, forma el complejo de especies de Borrelia burgdorferi sensu lato . El complejo actualmente comprende 20 genoespecies aceptadas y 3 propuestas. [3] B. burgdorferi sensu stricto existe en América del Norte y Eurasia y hasta 2016 era la única causa conocida de la enfermedad de Lyme en América del Norte. [4] [5] [3]
Borrelia burgdorferi recibe su nombre del investigador Willy Burgdorfer , quien aisló la bacteria por primera vez en 1982. [6]
Borrelia burgdorferi es una microaerófila que necesita pequeñas cantidades de oxígeno para poder experimentar la glucólisis y sobrevivir. Como todas las demás especies de Borrelia , esta bacteria también es gramnegativa y es una espiroqueta. Las colonias de Borrelia suelen ser más pequeñas, redondeadas y blancas con un centro elevado. [7] B. burgdorferi posee flagelos que le permiten la movilidad. Puede ser oxidasa negativa, pero B. burgdorferi posee un gen que codifica para la superóxido dismutasa . Esta proteína inhibe la acumulación de especies reactivas de oxígeno (ROS). [9] La bacteria parece ser capaz de utilizar muchos monosacáridos diferentes para su uso en la producción de energía. [13]
B. burgdorferi se parece a otras espiroquetas en que tiene una membrana externa y una membrana interna con una fina capa de peptidoglicano entre ellas. Se caracteriza por tener un pocillo celular flexible y tiene células largas y cilíndricas de aproximadamente 1 micrón de ancho. Sin embargo, la membrana externa carece de lipopolisacárido . Su forma es una onda plana. Tiene aproximadamente 0,3 μm de ancho y de 5 a 20 μm de largo. [14]
B. burgdorferi es una espiroqueta microaeróbica y móvil con siete a once flagelos periplasmáticos agrupados en cada extremo que le permiten moverse en medios de baja y alta viscosidad por igual, lo que está relacionado con su alto factor de virulencia. [15]
B. burgdorferi es una espiroqueta microaerófila de crecimiento lento con un tiempo de duplicación de 24 a 48 horas. [16]
Los investigadores han utilizado la transformación bacteriana para aislar genes patógenos específicos entre Borrelia burgdorferi . Las cepas de B. burgdorferi parecen ser altamente insuficientes para su uso en la transformación bacteriana debido a la gran cantidad de ADN necesaria para la transformación, el tiempo que lleva producir transformantes confiables y la influencia de los sistemas de modificación de restricción . [17] [18] De hecho, la infectividad de B. burgdorferi a menudo requiere el gen pncA , que está presente en un plásmido bacteriano que contiene el gen bbe02 que es altamente seleccionado en contra durante la transformación. Dado que estos genes a menudo están emparejados, la infectividad es seleccionada en contra en la transformación, contrarrestando la investigación para identificar genes particulares que funcionan en la patogenicidad de Borrelia burgdorferi . [19] A pesar de esto, se han logrado algunos avances en desentrañar los misterios de B. burgdorferi, como el descubrimiento del gen cyaB como esencial para la infección de mamíferos. [20]
B. burgdorferi circula entre garrapatas Ixodes y un huésped vertebrado en un ciclo enzoótico . [3] B. burgdorferi que vive en una garrapata se adquiere principalmente a través de comidas de sangre de un huésped vertebrado competente infectado, [21] pero existen casos raros de transmisión transovárica . [22] Una vez que una garrapata está infectada, transmitirá B. burgdorferi al alimentarse de otro vertebrado para completar el ciclo. [23] Las garrapatas pueden transmitir B. burgdorferi a los humanos, pero los humanos son huéspedes sin salida, es poco probable que continúen el ciclo de vida de la espiroqueta. [24] Las ninfas mudan a garrapatas adultas, que generalmente se alimentan de mamíferos más grandes que no pueden sustentar la supervivencia de B. burgdorferi . [25]
La B. burgdorferi es el agente causal de la enfermedad de Lyme y es por ello que esta bacteria es tan importante y se está estudiando. La transmisión más común es de garrapatas a humanos. Los humanos actúan como huéspedes de la garrapata para esta bacteria. La enfermedad de Lyme es una enfermedad zoonótica transmitida por vectores , transmitida por la garrapata Ixodes (también vector de Babesia y Anaplasma ). La ninfa infectada transmite B. burgdorferi a través de su saliva al humano durante su alimentación de sangre. [25]
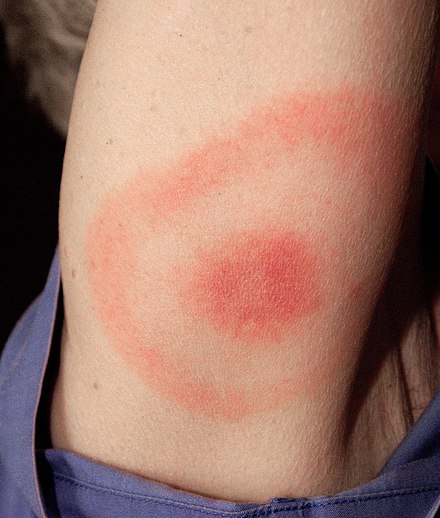
La presentación clínica de la enfermedad de Lyme es mejor conocida por la característica erupción en forma de ojo de buey (también conocida como eritema crónico migratorio ), pero también puede incluir miocarditis , miocardiopatía , arritmia , artritis , artralgia , meningitis , neuropatías y parálisis del nervio facial [26] dependiendo de la etapa de la infección.
Se ha encontrado que las infecciones por B. burgdorferi pueden estar asociadas con linfomas difusos de células B grandes cutáneos primarios (PCDLBCL), [27] [28] donde una revisión de la literatura primaria, a partir de 2010, señaló que la mayoría de los PCBCL examinados no han respondido a los antibióticos; [28] : 846 por lo tanto, como en el caso de la asociación de Chlamydophila psittaci con el linfoma de tejido linfoide asociado a la mucosa anexial ocular (linfoma MALT), la conclusión de trabajo fue que "si B. burgdorferi está realmente asociada con PCBCL, entonces existe una amplia variabilidad geográfica y probablemente estén involucrados otros factores". [28] : 846
La progresión de la enfermedad sigue tres etapas.
La etapa 1 se conoce como la etapa localizada temprana y ocurre aproximadamente entre 3 días y 1 mes después de la inoculación. Afecta el área local alrededor de la picadura y se caracteriza por hinchazón local y/o una erupción roja en forma de "ojo de buey" (también conocida como eritema crónico migratorio ) que se ve como un círculo eritematoso que rodea un centro definido que se expande hacia afuera. Puede alcanzar un tamaño de hasta 15 cm de diámetro. [29] : 658 Una vez que la erupción comienza a remitir, los primeros síntomas pueden manifestarse como síntomas "similares a los de la gripe". En esta etapa, los antibióticos son más eficaces para prevenir un mayor crecimiento y los síntomas de la enfermedad antes de que se manifiesten los síntomas principales. [29] : 659
La etapa 2 se conoce como la etapa de diseminación temprana y ocurre semanas o meses después de la infección si no se trata. La bacteria se propaga a través de la sangre a través del cuerpo para afectar los órganos. A menudo se presenta con síntomas generales como fiebre, escalofríos, fatiga y linfadenopatía, así como síntomas específicos de órganos. Puede afectar el corazón causando miocarditis , así como arritmias como bloqueos auriculoventriculares (que si son lo suficientemente importantes pueden requerir la inserción de un marcapasos). Puede afectar el sistema musculoesquelético causando artritis transitoria no inflamatoria y/o artralgias . Puede afectar el sistema nervioso manifestándose como parálisis facial ( parálisis de Bell , clásicamente bilateral), fatiga y pérdida de memoria. [ cita requerida ]
La etapa 3 se conoce como etapa diseminada tardía y ocurre meses o años después de la infección inicial. Los efectos de la etapa 3 incluyen encefalitis o meningitis, [29] así como artropatías migratorias (más comúnmente de la rodilla). [29]
La anaplasmosis y la babesiosis también son patógenos comunes transmitidos por garrapatas, transportados por la garrapata Ixodes que infecta a los humanos de manera similar a Borrelia burgdorferi . [30] En consecuencia, es posible que una garrapata Ixodes coinfecte a un huésped con dos o todas las demás enfermedades. Cuando un huésped está coinfectado, los efectos combinados de las enfermedades actúan de manera sinérgica, y a menudo demuestran causar síntomas peores que una única infección sola [30] Los humanos coinfectados tienden a mostrar una manifestación más grave de la enfermedad de Lyme. Además, tienden a adquirir una gama más amplia de síntomas secundarios, como síntomas similares a los de la gripe. [30] Se deben realizar más estudios e investigaciones para determinar el efecto sinérgico de la coinfección y su efecto en el cuerpo humano.
Hasta el momento, hay tres factores que pueden contribuir a la gravedad de la manifestación clínica de la enfermedad de Lyme. La presencia de espaciadores ribosómicos, plásmidos y la proteína C de la superficie externa (OspC) son indicadores de la gravedad de la infección. [31] Además, los propios seres humanos varían en su respuesta a la infección. [31] La variación en la respuesta conduce a diferentes manifestaciones clínicas y diferentes infecciones en diferentes órganos. [ cita requerida ]
Una vez que el patógeno se transmite, se aclimatará a las condiciones de los mamíferos. Borrelia burgdorferi cambiará sus glicoproteínas y proteasas en su membrana plasmática para facilitar su diseminación por la sangre. [31] Mientras infecta, B. burgdorferi expresará proteínas que interactuarán con las células endoteliales , plaquetas , condrocitos y la matriz extracelular . [31] Esta interacción inhibe el funcionamiento adecuado de las áreas infectadas, lo que conduce a las manifestaciones patológicas de la enfermedad de Lyme. En respuesta, el huésped iniciará una respuesta inflamatoria para intentar eliminar la infección. [31]
Borrelia burgdorferi también expresa al menos siete proteínas de unión al plasminógeno que interfieren con el factor H a nivel de activación. Esto forma parte de una estrategia de evasión del sistema del complemento que conduce al bloqueo posterior de la respuesta inmunitaria. [32]
Además, Borrelia burgdorferi tiene una estrategia para inhibir directamente la vía clásica del sistema del complemento. Una lipoproteína borrelial BBK32, expresada en la superficie de Borrelia burgdorferi , se une al complejo de proteasa iniciador C1 de la vía clásica. Más específicamente, BBK32 interactúa con la subunidad C1r de C1. El dominio C-terminal de la proteína BBK32 media la unión. Como resultado, C1 queda atrapado en una forma inactiva. [33]
B. burgdorferi (cepa B31) fue el tercer genoma microbiano secuenciado , después de la secuenciación de Haemophilus influenzae y Mycoplasma genitalium en 1995. Su cromosoma lineal contiene 910.725 pares de bases y 853 genes . [34] El método de secuenciación utilizado fue el de escopeta de genoma completo . El proyecto de secuenciación, publicado en Nature en 1997 y en Molecular Microbiology en 2000, se llevó a cabo en el Instituto de Investigación Genómica . [35] El genoma de B. burgdorferi consta de un cromosoma de megabases y una variedad inusual de plásmidos circulares y lineales que varían en tamaño de 9 a 62 kilobases. [23] El cromosoma de megabases, a diferencia de muchas otras eubacterias, no tiene relación ni con la virulencia de la bacteria ni con la interacción huésped-parásito. [34] Algunos de los plásmidos son necesarios para el ciclo de vida de B. burgdorferi pero no para la propagación de la bacteria en cultivo. [23]
Las variaciones genómicas de B. burgdorferi contribuyen a diversos grados de infección y diseminación. [36] Cada grupo genómico tiene antígenos variables en su receptor de membrana, que son específicos para la infección del huésped. Uno de estos receptores de membrana es la proteína de superficie OspC. [36] Se ha demostrado que la proteína de superficie OspC es un fuerte indicador de la identificación de la clasificación genómica y el grado de diseminación. [36] La cantidad variable de loci OspC son indicaciones y determinantes para las variaciones de B. burgdorferi . [36] La proteína de superficie también está a la vanguardia de la investigación actual de vacunas para la enfermedad de Lyme a través de Borrelia . [37]
Se sabe que relativamente pocos bacteriófagos infectan a B. burgdorferi . Se aislaron varias partículas de fagos y algunas evidencias sugirieron que tenían un genoma de dsADN de 8 kb. Entre los fagos de Borrelia mejor estudiados se encuentra φBB-1, un fago con una cabeza poliédrica y una cola contráctil de 90 nm de longitud. [38] [39] φBB-1 fue el primer bacteriófago que proporcionó evidencia de transducción para transferencia lateral de genes en especies de Borrelia que causan la enfermedad de Lyme. [40] La investigación actual tiene como objetivo utilizar bacteriófagos como una forma de identificar factores de virulencia en espiroquetas que conducen a la enfermedad de Lyme. [ cita requerida ]
En el noreste de los Estados Unidos se mantienen cepas de B. burgdorferi genéticamente diversas , definidas por la secuencia de ospC . La selección equilibradora puede actuar sobre ospC o una secuencia cercana para mantener la variedad genética de B. burgdorferi . [41] La selección equilibradora es el proceso por el cual se mantienen múltiples versiones de un gen dentro del acervo genético a frecuencias inesperadamente altas. Dos modelos principales que controlan el equilibrio de la selección de B. burgdorferi son la selección dependiente de la frecuencia negativa y el polimorfismo de nicho múltiple . [42] Estos modelos pueden explicar cómo se ha diversificado B. burgdorferi y cómo la selección puede haber afectado la distribución de las variantes de B. burgdorferi , o la variación de rasgos específicos de la especie, en ciertos entornos. [ cita requerida ]
En la selección dependiente de la frecuencia negativa, las variantes raras y poco comunes tendrán una ventaja selectiva sobre las variantes que son muy comunes en un entorno. [42] Para B. burgdorferi , las variantes de baja frecuencia serán ventajosas porque los huéspedes potenciales tendrán menos probabilidades de generar una respuesta inmunológica a la proteína externa OspC específica de la variante. [42]
Los nichos ecológicos son todas las variables de un entorno, como los recursos, los competidores y las respuestas, que contribuyen a la aptitud del organismo. El polimorfismo de nichos múltiples establece que la diversidad se mantiene dentro de una población debido a la cantidad variable de nichos y entornos posibles. [42] Por lo tanto, cuanto más diversos sean los nichos, mayor será la probabilidad de polimorfismo y diversidad. En el caso de B. burgdorferi , la variación de los nichos de las vértebras, como los ciervos y los ratones, puede afectar a la selección de equilibrio general para las variantes. [42]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento de CS1: otros ( enlace )