
La fórmula estructural de un compuesto químico es una representación gráfica de la estructura molecular (determinada por métodos de química estructural ), que muestra cómo se organizan posiblemente los átomos en el espacio tridimensional real . También se muestra el enlace químico dentro de la molécula, ya sea explícita o implícitamente. A diferencia de otros tipos de fórmulas químicas , [a] que tienen un número limitado de símbolos y son capaces de un poder descriptivo limitado, las fórmulas estructurales proporcionan una representación geométrica más completa de la estructura molecular. Por ejemplo, muchos compuestos químicos existen en diferentes formas isoméricas , que tienen diferentes estructuras enantioméricas pero la misma fórmula molecular . Hay varios tipos de formas de dibujar estas fórmulas estructurales, como: estructuras de Lewis , fórmulas condensadas, fórmulas esqueléticas , proyecciones de Newman , conformaciones de ciclohexano , proyecciones de Haworth y proyecciones de Fischer . [2]
Se utilizan varios formatos sistemáticos de nomenclatura química , como en las bases de datos químicas , que son equivalentes a las estructuras geométricas y tan potentes como ellas. Estos sistemas de nomenclatura química incluyen SMILES , InChI y CML . Estos nombres químicos sistemáticos se pueden convertir en fórmulas estructurales y viceversa, pero los químicos casi siempre describen una reacción química o síntesis utilizando fórmulas estructurales en lugar de nombres químicos, porque las fórmulas estructurales permiten al químico visualizar las moléculas y los cambios estructurales que ocurren en ellas durante las reacciones químicas. ChemSketch y ChemDraw son descargas/sitios web populares que permiten a los usuarios dibujar reacciones y fórmulas estructurales, normalmente en el estilo de la estructura de Lewis.
Los enlaces se muestran a menudo como una línea que conecta un átomo con otro. Una línea indica un enlace simple . Dos líneas indican un enlace doble y tres líneas indican un enlace triple . En algunas estructuras, se especifican y se muestran los átomos entre cada enlace. Sin embargo, en algunas estructuras, las moléculas de carbono no se escriben específicamente. En cambio, estos carbonos se indican mediante una esquina que se forma cuando se conectan dos líneas. Además, los átomos de hidrógeno están implícitos y no suelen dibujarse. Estos se pueden inferir en función de cuántos otros átomos está unido el carbono. Por ejemplo, si el carbono A está unido a otro carbono B, el carbono A tendrá tres hidrógenos para llenar su octeto. [3]



Los electrones se representan generalmente en círculos coloreados. Un círculo indica un electrón. Dos círculos indican un par de electrones. Normalmente, un par de electrones también indica una carga negativa. Al utilizar los círculos de colores, se indica el número de electrones en la capa de valencia de cada átomo respectivo, lo que proporciona información descriptiva adicional sobre la capacidad reactiva de ese átomo en la molécula. [3]
A menudo, los átomos tendrán una carga positiva o negativa , ya que su octeto puede no estar completo. Si al átomo le falta un par de electrones o tiene un protón, tendrá una carga positiva. Si el átomo tiene electrones que no están unidos a otro átomo, tendrá una carga negativa. En las fórmulas estructurales, la carga positiva se indica con ⊕ y la carga negativa con ⊖. [3]


La quiralidad en las fórmulas esqueléticas se indica mediante el método de proyección de Natta . La estereoquímica se utiliza para mostrar la disposición espacial relativa de los átomos en una molécula. Para mostrar esto se utilizan cuñas, y hay dos tipos: discontinuas y rellenas. Una cuña rellena indica que el átomo está en la parte delantera de la molécula; está apuntando por encima del plano del papel hacia el frente. Una cuña discontinua indica que el átomo está detrás de la molécula; está apuntando por debajo del plano del papel. Cuando se utiliza una línea recta, sin discontinuidades, el átomo está en el plano del papel. Esta disposición espacial proporciona una idea de la molécula en un espacio tridimensional y existen restricciones en cuanto a cómo se pueden organizar las disposiciones espaciales. [3]
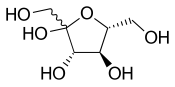
Los enlaces simples ondulados representan una estereoquímica desconocida o no especificada o una mezcla de isómeros. Por ejemplo, el diagrama adyacente muestra la molécula de fructosa con un enlace ondulado al grupo HOCH 2 - a la izquierda. En este caso, las dos posibles estructuras de anillo están en equilibrio químico entre sí y también con la estructura de cadena abierta. El anillo se abre y se cierra automáticamente, a veces cerrándose con una estereoquímica y a veces con la otra.
Las fórmulas esqueléticas pueden representar isómeros cis y trans de alquenos. Los enlaces simples ondulados son la forma estándar de representar una estereoquímica desconocida o no especificada o una mezcla de isómeros (como en el caso de los estereocentros tetraédricos). A veces se ha utilizado un doble enlace cruzado, pero ya no se considera un estilo aceptable para el uso general. [4]

Las estructuras de Lewis (o "estructuras de puntos de Lewis") son fórmulas gráficas planas que muestran la conectividad de los átomos y los pares solitarios o electrones desapareados , pero no la estructura tridimensional. Esta notación se utiliza principalmente para moléculas pequeñas. Cada línea representa los dos electrones de un enlace simple . Dos o tres líneas paralelas entre pares de átomos representan enlaces dobles o triples, respectivamente. Alternativamente, se pueden utilizar pares de puntos para representar pares de enlaces. Además, se indican todos los electrones no enlazados (emparejados o desapareados) y cualquier carga formal en los átomos. A través del uso de estructuras de Lewis , la colocación de electrones, ya sea en un enlace o en pares solitarios , permitirá la identificación de las cargas formales de los átomos en la molécula para comprender la estabilidad y determinar la molécula más probable (según la diferencia de geometría molecular ) que se formaría en una reacción. Las estructuras de Lewis dan algo de importancia a la geometría de la molécula, ya que a menudo los enlaces se dibujan en ciertos ángulos para representar la molécula en la vida real. La estructura de Lewis se utiliza mejor para calcular las cargas formales o cómo se unen los átomos entre sí, ya que se muestran tanto los electrones como los enlaces. Las estructuras de Lewis dan una idea de la geometría molecular y electrónica, que varía en función de la presencia de enlaces y pares solitarios, y a través de esto se pueden determinar también los ángulos de enlace y la hibridación .
En las primeras publicaciones de química orgánica, donde el uso de gráficos estaba muy limitado, surgió un sistema tipográfico para describir las estructuras orgánicas en una línea de texto. Aunque este sistema tiende a ser problemático en su aplicación a compuestos cíclicos, sigue siendo una forma conveniente de representar estructuras simples:
Los paréntesis se utilizan para indicar varios grupos idénticos, indicando la unión al átomo no hidrógeno más cercano a la izquierda cuando aparecen dentro de una fórmula, o al átomo a la derecha cuando aparecen al comienzo de una fórmula:
En todos los casos, se muestran todos los átomos, incluidos los átomos de hidrógeno. También es útil mostrar los carbonilos donde se encuentran los átomos de hidrógeno.
Se da a entender que está entre corchetes. Por ejemplo:
( acetona )
Por lo tanto, es importante mirar a la izquierda del átomo en el corchete para asegurarse de a qué átomo está unido. Esto es útil al convertir de una fórmula condensada a otra forma de fórmula estructural, como la fórmula esquelética o las estructuras de Lewis . Hay diferentes formas de mostrar los diversos grupos funcionales en las fórmulas condensadas, como aldehído como , ácidos carboxílicos como o , ésteres como o . Sin embargo, el uso de fórmulas condensadas no da una idea inmediata de la geometría molecular del compuesto o el número de enlaces entre los carbonos, es necesario reconocerlo en función del número de átomos unidos a los carbonos y si hay alguna carga en el carbono. [5]
Las fórmulas esqueléticas son la notación estándar para moléculas orgánicas más complejas. En este tipo de diagrama, utilizado por primera vez por el químico orgánico Friedrich August Kekulé von Stradonitz , [6] se implica que los átomos de carbono están ubicados en los vértices (esquinas) y extremos de segmentos de línea en lugar de indicarse con el símbolo atómico C. Los átomos de hidrógeno unidos a átomos de carbono no se indican: se entiende que cada átomo de carbono está asociado con suficientes átomos de hidrógeno para dar al átomo de carbono cuatro enlaces. La presencia de una carga positiva o negativa en un átomo de carbono toma el lugar de uno de los átomos de hidrógeno implícitos. Los átomos de hidrógeno unidos a átomos distintos del carbono deben escribirse explícitamente. Una característica adicional de las fórmulas esqueléticas es que al agregar ciertas estructuras se puede determinar la estereoquímica , es decir, la estructura tridimensional, del compuesto. A menudo, la fórmula esquelética puede indicar la estereoquímica mediante el uso de cuñas en lugar de líneas. Las cuñas sólidas representan enlaces que apuntan por encima del plano del papel, mientras que las cuñas discontinuas representan enlaces que apuntan por debajo del plano.
La proyección de Newman y la proyección de caballete se utilizan para representar conformadores específicos o para distinguir la estereoquímica vecinal . En ambos casos, dos átomos de carbono específicos y su enlace de conexión son el centro de atención. La única diferencia es una perspectiva ligeramente diferente: la proyección de Newman mira directamente hacia abajo del enlace de interés, la proyección de caballete mira el mismo enlace pero desde un punto de vista algo oblicuo . En la proyección de Newman, se utiliza un círculo para representar un plano perpendicular al enlace, que distingue los sustituyentes en el carbono frontal de los sustituyentes en el carbono posterior. En la proyección de caballete, el carbono frontal suele estar a la izquierda y siempre está ligeramente más abajo. A veces, se utiliza una flecha para indicar el carbono frontal. La proyección de caballete es muy similar a una fórmula esquelética, e incluso puede utilizar cuñas en lugar de líneas para indicar la estereoquímica de la molécula. La proyección de caballete se distingue de las fórmulas esqueléticas porque la proyección de caballete no es un muy buen indicador de la geometría de la molécula y la disposición molecular. Se pueden utilizar tanto la proyección de Newman como la de Sawhorse para crear una proyección de Fischer.
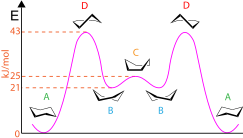
Ciertas conformaciones del ciclohexano y otros compuestos de anillos pequeños se pueden mostrar utilizando una convención estándar. Por ejemplo, la conformación estándar de silla del ciclohexano implica una vista en perspectiva desde un poco por encima del plano promedio de los átomos de carbono e indica claramente qué grupos son axiales (apuntando verticalmente hacia arriba o hacia abajo) y cuáles son ecuatoriales (casi horizontales, ligeramente inclinados hacia arriba o hacia abajo). Los enlaces al frente pueden o no estar resaltados con líneas más fuertes o cuñas. Las conformaciones progresan de la siguiente manera: silla a media silla a bote retorcido a bote a bote retorcido a media silla a silla. Las conformaciones del ciclohexano también se pueden utilizar para mostrar la energía potencial presente en cada etapa como se muestra en el diagrama. Las conformaciones de silla (A) tienen la energía más baja, mientras que las conformaciones de media silla (D) tienen la energía más alta. Hay un pico/máximo local en la conformación de bote (C), y hay valles/mínimos locales en las conformaciones de bote retorcido (B). Además, las conformaciones de ciclohexano se pueden utilizar para indicar si la molécula tiene interacciones diaxiales 1,3, que son interacciones estéricas entre sustituyentes axiales en los carbonos 1,3 y 5. [7]
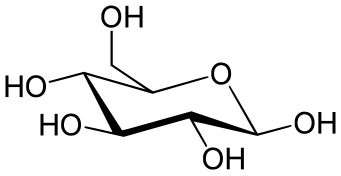
La proyección de Haworth se utiliza para los azúcares cíclicos . No se distinguen las posiciones axial y ecuatorial; en cambio, los sustituyentes se ubican directamente encima o debajo del átomo del anillo al que están conectados. Los sustituyentes de hidrógeno generalmente se omiten.
Sin embargo, una cosa importante a tener en cuenta al leer una proyección de Haworth es que las estructuras de los anillos no son planas. Por lo tanto, Haworth no proporciona una forma 3-D. Sir Norman Haworth , fue un químico británico, que ganó un Premio Nobel por su trabajo sobre los carbohidratos y el descubrimiento de la estructura de la vitamina C. Durante su descubrimiento, también dedujo diferentes fórmulas estructurales que ahora se conocen como Proyecciones de Haworth. En una Proyección de Haworth, un azúcar piranosa se representa como un hexágono y un azúcar furanosa se representa como un pentágono. Por lo general, un oxígeno se coloca en la esquina superior derecha en la piranosa y en el centro superior en un azúcar furanosa. Los enlaces más delgados en la parte superior del anillo se refieren a los enlaces que están más lejos y los enlaces más gruesos en la parte inferior del anillo se refieren al extremo del anillo que está más cerca del espectador. [8]

La proyección de Fischer se utiliza principalmente para monosacáridos lineales . En cualquier centro de carbono dado, las líneas de enlace verticales son equivalentes a marcas estereoquímicas rayadas, dirigidas lejos del observador, mientras que las líneas horizontales son equivalentes a cuñas, apuntando hacia el observador. La proyección es poco realista, ya que un sacárido nunca adoptaría esta conformación eclipsada múltiples veces . No obstante, la proyección de Fischer es una forma sencilla de representar múltiples estereocentros secuenciales que no requiere ni implica ningún conocimiento de la conformación real. Una proyección de Fischer restringirá una molécula 3-D a 2-D y, por lo tanto, existen limitaciones para cambiar la configuración de los centros quirales. Las proyecciones de Fischer se utilizan para determinar la configuración R y S en un carbono quiral y se hace utilizando las reglas de Cahn Ingold Prelog . Es una forma conveniente de representar y distinguir entre enantiómeros y diastereómeros . [8]
Una fórmula estructural es un modelo simplificado que no puede representar ciertos aspectos de las estructuras químicas. Por ejemplo, el enlace formalizado puede no ser aplicable a sistemas dinámicos como los enlaces deslocalizados . La aromaticidad es un caso de este tipo y se basa en la convención para representar el enlace. Diferentes estilos de fórmulas estructurales pueden representar la aromaticidad de diferentes maneras, lo que lleva a diferentes representaciones del mismo compuesto químico. Otro ejemplo son los dobles enlaces formales donde la densidad electrónica se distribuye fuera del enlace formal, lo que lleva a un carácter de doble enlace parcial y una interconversión lenta a temperatura ambiente. Para todos los efectos dinámicos, la temperatura afectará las tasas de interconversión y puede cambiar cómo debe representarse la estructura. No hay una temperatura explícita asociada con una fórmula estructural, aunque muchos suponen que sería la temperatura estándar .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )