La histidina (símbolo His o H ) [2] es un aminoácido esencial que se utiliza en la biosíntesis de proteínas . Contiene un grupo α-amino (que está en la forma protonada –NH 3 + en condiciones biológicas ), un grupo de ácido carboxílico (que está en la forma desprotonada –COO − en condiciones biológicas) y una cadena lateral de imidazol (que está parcialmente protonada), clasificándolo como un aminoácido con carga positiva a pH fisiológico . Inicialmente se pensó que era esencial solo para los bebés, pero ahora se ha demostrado en estudios a largo plazo que también es esencial para los adultos. [3] Está codificado por los codones CAU y CAC.
La histidina fue aislada por primera vez por Albrecht Kossel y Sven Gustaf Hedin en 1896. [4] El nombre proviene de su descubrimiento en el tejido, de ἱστός histós "tejido". [2] También es un precursor de la histamina , un agente inflamatorio vital en las respuestas inmunitarias. El radical acilo es histidilo .
El ácido conjugado (forma protonada) de la cadena lateral de imidazol en la histidina tiene un p K a de aproximadamente 6,0. Por lo tanto, por debajo de un pH de 6, el anillo de imidazol está mayoritariamente protonado (como se describe en la ecuación de Henderson-Hasselbalch ). El anillo de imidazolio resultante tiene dos enlaces NH y tiene una carga positiva. La carga positiva se distribuye equitativamente entre ambos nitrógenos y se puede representar con dos estructuras de resonancia igualmente importantes . A veces, se utiliza el símbolo Hip para esta forma protonada en lugar del habitual His. [5] [6] [7] Por encima de pH 6, se pierde uno de los dos protones. El protón restante del anillo de imidazol puede residir en cualquiera de los nitrógenos, dando lugar a lo que se conoce como tautómeros N3-H o N1-H . El tautómero N3-H se muestra en la figura anterior. En el tautómero N1-H, el NH está más cerca de la cadena principal. Estos tautómeros neutros, también denominados Nε y Nδ, a veces se denominan con los símbolos Hie y Hid , respectivamente. [5] [6] [7] El anillo de imidazol/imidazolio de la histidina es aromático en todos los valores de pH. [8] En determinadas condiciones, los tres grupos formadores de iones de la histidina pueden cargarse formando el catión histidinio. [9]
Las propiedades ácido-base de la cadena lateral de imidazol son relevantes para el mecanismo catalítico de muchas enzimas . [10] En las tríadas catalíticas , el nitrógeno básico de la histidina abstrae un protón de la serina , treonina o cisteína para activarla como nucleófilo . En una lanzadera de protones de histidina, la histidina se utiliza para transportar rápidamente protones. Puede hacer esto abstrayendo un protón con su nitrógeno básico para hacer un intermedio cargado positivamente y luego usar otra molécula, un tampón, para extraer el protón de su nitrógeno ácido. En las anhidrasas carbónicas , se utiliza una lanzadera de protones de histidina para transportar rápidamente protones lejos de una molécula de agua unida a zinc para regenerar rápidamente la forma activa de la enzima. En las hélices E y F de la hemoglobina , la histidina influye en la unión del dioxígeno y del monóxido de carbono . Esta interacción aumenta la afinidad del Fe(II) por el O2 pero desestabiliza la unión del CO, que se une sólo 200 veces más fuerte en la hemoglobina, en comparación con 20.000 veces más fuerte en el hemo libre .
El tautomerismo y las propiedades ácido-base de la cadena lateral de imidazol se han caracterizado mediante espectroscopia de RMN de 15 N. Los dos desplazamientos químicos de 15 N son similares (aproximadamente 200 ppm, en relación con el ácido nítrico en la escala sigma, en la que un mayor apantallamiento corresponde a un mayor desplazamiento químico ). Las mediciones espectrales de RMN muestran que el desplazamiento químico de N1-H disminuye ligeramente, mientras que el desplazamiento químico de N3-H disminuye considerablemente (aproximadamente 190 frente a 145 ppm). Este cambio indica que se prefiere el tautómero N1-H, posiblemente debido a la unión de hidrógeno con el amonio vecino . El apantallamiento en N3 se reduce sustancialmente debido al efecto paramagnético de segundo orden , que implica una interacción permitida por la simetría entre el par solitario de nitrógeno y los estados π* excitados del anillo aromático . A pH > 9, los desplazamientos químicos de N1 y N3 son aproximadamente 185 y 170 ppm. [11]


La histidina forma complejos con muchos iones metálicos. La cadena lateral de imidazol del residuo de histidina suele actuar como ligando en las metaloproteínas . Un ejemplo es la base axial unida al Fe en la mioglobina y la hemoglobina. Las etiquetas de polihistidina (de seis o más residuos H consecutivos) se utilizan para la purificación de proteínas mediante la unión a columnas con níquel o cobalto, con afinidad micromolar. [12] Se ha demostrado que los péptidos de polihistidina naturales, que se encuentran en el veneno de la víbora Atheris squamigera , se unen a Zn(2+), Ni(2+) y Cu(2+) y afectan la función de las metaloproteasas del veneno. [13]
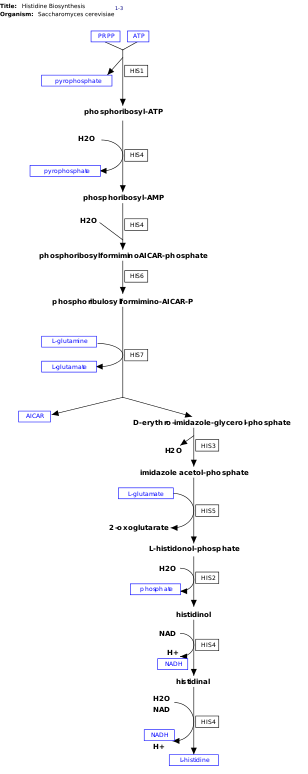
La l -histidina es un aminoácido esencial que no se sintetiza de novo en los seres humanos. [14] Los seres humanos y otros animales deben ingerir histidina o proteínas que contengan histidina. La biosíntesis de la histidina ha sido ampliamente estudiada en procariotas como E. coli . La síntesis de histidina en E. coli involucra ocho productos genéticos (His1, 2, 3, 4, 5, 6, 7 y 8) y ocurre en diez pasos. Esto es posible porque un solo producto genético tiene la capacidad de catalizar más de una reacción. Por ejemplo, como se muestra en la vía, His4 cataliza 4 pasos diferentes en la vía. [15]
La histidina se sintetiza a partir de pirofosfato de fosforribosil (PRPP), que se produce a partir de ribosa-5-fosfato por la ribosa-fosfato difosfoquinasa en la vía de las pentosas fosfato . La primera reacción de la biosíntesis de histidina es la condensación de PRPP y trifosfato de adenosina (ATP) por la enzima ATP-fosforribosil transferasa . La ATP-fosforribosil transferasa está indicada por His1 en la imagen. [15] El producto del gen His4 luego hidroliza el producto de la condensación, fosforribosil-ATP, produciendo fosforribosil-AMP (PRAMP), que es un paso irreversible. Luego, His4 cataliza la formación de fosforribosilformiminoAICAR-fosfato, que luego se convierte en fosforibulosilformimino-AICAR-P por el producto del gen His6. [16] His7 divide el fosforibulosilformimino-AICAR-P para formar d -eritro-imidazol-glicerol-fosfato. Después, His3 forma imidazol acetol-fosfato liberando agua. His5 luego forma l -histidinal-fosfato, que luego es hidrolizado por His2 formando histidinol. His4 cataliza la oxidación de l- histidinal para formar l -histidinal, un aminoaldehído. En el último paso, l -histidinal se convierte en l- histidina. [16] [17]
La vía de biosíntesis de histidina se ha estudiado en el hongo Neurospora crassa , y se encontró un gen ( His-3 ) que codifica un complejo multienzimático que era similar al gen His4 de la bacteria E. coli . [18] Un estudio genético de mutantes de histidina de N. crassa indicó que las actividades individuales del complejo multienzimático ocurren en secciones discretas y contiguas del mapa genético His-3 , lo que sugiere que las diferentes actividades del complejo multienzimático se codifican por separado unas de otras. [18] Sin embargo, también se encontraron mutantes que carecían de las tres actividades simultáneamente, lo que sugiere que algunas mutaciones causan la pérdida de la función del complejo en su conjunto.
Al igual que los animales y los microorganismos, las plantas necesitan histidina para su crecimiento y desarrollo. [10] Los microorganismos y las plantas son similares en el sentido de que pueden sintetizar histidina. [19] Ambos sintetizan histidina a partir del intermediario bioquímico pirofosfato de fosforribosil. En general, la biosíntesis de histidina es muy similar en plantas y microorganismos. [20]
Esta vía requiere energía para poder llevarse a cabo, por lo tanto, la presencia de ATP activa la primera enzima de la vía, la ATP-fosforribosil transferasa (mostrada como His1 en la imagen de la derecha). La ATP-fosforribosil transferasa es la enzima que determina la velocidad, que se regula a través de inhibición por retroalimentación, lo que significa que se inhibe en presencia del producto, histidina. [21]
La histidina es uno de los aminoácidos que se pueden convertir en intermediarios del ciclo del ácido tricarboxílico (TCA) (también conocido como ciclo del ácido cítrico). [22] La histidina, junto con otros aminoácidos como la prolina y la arginina, participa en la desaminación, un proceso en el que se elimina su grupo amino. En los procariotas , la histidina se convierte primero en urocanato por la histidasa. Luego, la urocanasa convierte el urocanato en 4-imidazolona-5-propionato. La imidazolonapropionasa cataliza la reacción para formar formiminoglutamato (FIGLU) a partir de 4-imidazolona-5-propionato. [23] El grupo formimino se transfiere a tetrahidrofolato y los cinco carbonos restantes forman glutamato. [22] En general, estas reacciones dan como resultado la formación de glutamato y amoníaco. [24] El glutamato puede luego ser desaminado por la glutamato deshidrogenasa o transaminado para formar α-cetoglutarato. [22]

En 2002, la Junta de Alimentos y Nutrición (FNB) del Instituto de Medicina de los Estados Unidos estableció las cantidades dietéticas recomendadas (RDA) para los aminoácidos esenciales. En el caso de la histidina, para los adultos de 19 años o más, 14 mg/kg de peso corporal/día. [29] Se está investigando el uso de histidina suplementaria para una variedad de afecciones diferentes, incluidos los trastornos neurológicos, la dermatitis atópica, el síndrome metabólico, la diabetes, la anemia urémica, las úlceras, las enfermedades inflamatorias del intestino, las neoplasias malignas y el rendimiento muscular durante el ejercicio extenuante. [30]