La inmunoquímica de los glutens de Triticeae es importante en varias enfermedades inflamatorias. Puede subdividirse en respuestas innatas (estimulación directa del sistema inmunológico), presentación mediada por clase II ( HLA DQ ), estimulación mediada por clase I de las células asesinas y reconocimiento de anticuerpos . Las respuestas a las proteínas del gluten y las regiones polipeptídicas difieren según el tipo de sensibilidad al gluten. La respuesta también depende de la composición genética de los genes del antígeno leucocitario humano . En la enteropatía sensible al gluten, hay cuatro tipos de reconocimiento, inmunidad innata (una forma de preparación de la inmunidad celular), HLA-DQ y reconocimiento de anticuerpos de gliadina y transglutaminasa . Con la sensibilidad al gluten idiopática solo se ha resuelto el reconocimiento de anticuerpos a la gliadina. En la alergia al trigo , las vías de respuesta están mediadas por IgE contra otras proteínas del trigo y otras formas de gliadina.

La inmunidad innata al gluten se refiere a una respuesta inmune que funciona independientemente del reconocimiento del péptido "innato" por parte de los receptores de células T o de los anticuerpos . Este péptido actúa directamente sobre las células, como los monocitos, estimulando su crecimiento y diferenciación. [1] La inmunidad innata al gluten se complica por un papel aparente que tiene el gluten al eludir los mecanismos normales de defensa del huésped y de exclusión de péptidos en el intestino. Si bien no es verdaderamente innata, estas actividades permiten que la gliadina ingrese a áreas donde se encuentran muchos linfocitos. Al eludir estos filtros, la gliadina altera el comportamiento normal tanto de las células digestivas, llamadas enterocitos o células epiteliales, como de los linfocitos. Esto aumenta el potencial de causar sensibilidad (ver Afecciones subyacentes). Una posible explicación de por qué ciertas personas se vuelven sensibles es que estos individuos pueden no producir peptidasas adecuadas en algunas áreas del intestino, lo que permite que estos péptidos sobrevivan. Otra explicación para algunos puede ser que los productos químicos de los alimentos o los medicamentos estén debilitando las defensas. Este puede ser el caso de la alergia a la gliadina ω5 con sensibilidad al salicilato. No existe un razonamiento claro, ni genético ni de estudios a largo plazo con individuos susceptibles, que explique por qué estas restricciones de péptidos intestinales cambiarían.
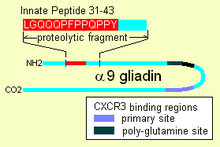
Una vez dentro, la gliadina α-9 31-55 muestra la capacidad de activar células inmunes indiferenciadas que luego proliferan y también producen citocinas inflamatorias , en particular la interleucina 15 (IL-15). Esto produce una serie de respuestas posteriores que son proinflamatorias. El otro péptido que puede tener un comportamiento innato es el péptido de unión al receptor "CXCR3", el receptor existe en los enterocitos, las células de la membrana del borde en cepillo. El péptido desplaza un factor inmunológico y señala la interrupción del sello de la membrana, las uniones estrechas, entre las células.
El gluten contiene un péptido de respuesta innata (IRP) que se encuentra en la gliadina α-9, en las posiciones 31-43 y en las gliadinas α-3, 4, 5, 8 y 11. El IRP se encuentra dentro de una región de 25 aminoácidos de longitud que es resistente a las proteasas pancreáticas . El 25mer también es resistente a las peptidasas de membrana del borde en cepillo del intestino delgado en los celíacos. [3] El IRP induce la expresión rápida de la interleucina 15 (IL15) y otros factores. [4] Por lo tanto, el IRP activa el sistema inmunológico. [1] [5] Los estudios muestran que, mientras que en individuos normales el péptido se recorta con el tiempo para producir un péptido inactivo, en los celíacos un 19mer puede perder un residuo de un extremo o del otro, después de una incubación prolongada que el 50% permanece intacto.
La liberación de IL15 es un factor importante en la enfermedad celíaca, ya que se ha descubierto que IL15 atrae a los linfocitos intraepiteliales (IEL) que caracterizan la enfermedad celíaca de grado 1 y 2 de Marsh. [6] Los linfocitos atraídos por IL-15 están compuestos de marcadores enriquecidos en células asesinas naturales frente a las células T auxiliares normales . Una hipótesis es que IL-15 induce la respuesta Th1 altamente inflamatoria que activa las células T auxiliares (gliadina específica restringida por DQ2) que luego orquestan la respuesta destructiva, pero no se conoce la razón por la que las células inflamatorias se desarrollan antes que las células auxiliares específicas de gliadina. [7] La respuesta de IRP difiere de las respuestas típicas que estimulan la liberación de IL15, como la infección viral . Además, otras citocinas como IL12 e IL2 , que normalmente se asocian con la estimulación de las células T auxiliares, no están implicadas. De estas dos formas, la activación peptídica innata de las células T en la enfermedad celíaca es extraña. La IL-15 parece inducir aumentos en MICA y NKG2D que pueden aumentar la muerte de células del borde en cepillo. [1]
Además, la inmunidad innata al péptido IRP está involucrada en la enfermedad celíaca , la dermatitis herpetiforme y posiblemente la diabetes juvenil . El IRP se dirige a los monocitos y aumenta la producción de IL-15 por una vía independiente de HLA-DQ , un estudio posterior mostró que tanto esta región como el "33mer" podrían crear la misma respuesta, tanto en células de celíacos tratados como de no celíacos. Sin embargo, a diferencia de los no celíacos, las células celíacas tratadas producen el marcador de la enfermedad nitrito . [8] Esto indica que otra anomalía en personas con enfermedad celíaca que permite que la estimulación continúe más allá del estado saludable normal. Después de un estudio extenso, no se conoce una asociación genética para esto que parezca sobresalir en la actualidad, e implica otros factores ambientales en el defecto.
Algunas gliadinas alfa tienen otras propiedades de acción directa . Otros péptidos de gliadina, uno en una región rica en glutamina y otro péptido, "QVLQQSTYQLLQELCCQHLW", se unen a un receptor quimioatrayente, CXCR3 . La gliadina se une a, bloquea y desplaza un factor, I-TAC, que se une a este receptor. [2] En el proceso, recluta más receptor CXCR3, aumenta la expresión de MyD88 y zonulina . [1] [9] El factor que desplaza, I-TAC, es un atrayente de células T. Este péptido también puede estar involucrado en un mayor riesgo de diabetes tipo 1 , ya que la producción de zonulina también es un factor. [10] Esta activación de la zonulina finalmente da como resultado la degradación de las uniones estrechas, lo que permite que grandes solutos, como fragmentos de gliadina resistentes a la proteolítica, ingresen detrás de las células de la membrana del borde en cepillo.
Un estudio examinó el efecto de la gliadina ω-5, la causa principal de WD-EIA , y encontró una mayor permeabilidad de las células intestinales. [11] Otros estudios muestran que la reactividad de IgE a la gliadina ω-5 aumenta en gran medida cuando se desamida o se reticula con transglutaminasa. [12]
Las restricciones de HLA de clase I a la gliadina no están bien caracterizadas. Se ha investigado la presentación de HLA-A2 . Los antígenos HLA-A pueden mediar la apoptosis en la enfermedad autoinmune y se ha documentado HLA A*0201 en con los haplotipos HLA-DQ8 . [13] Los sitios de clase I se encontraron en el extremo carboxilo de la gliadina en las posiciones 123-131, 144-152 y 172-180. La participación de las respuestas de clase I puede ser menor, ya que los anticuerpos a la transglutaminasa se correlacionan con la patogénesis y el reconocimiento de la matriz extracelular y la transglutaminasa de la superficie celular puede explicar la destrucción dentro de la enfermedad celíaca. Este proceso implica citotoxicidad celular dependiente de anticuerpos . En lo que respecta a un receptor llamado FOS, eufemísticamente llamado "receptor de la muerte", los enterocitos parecen sobreexpresar el receptor en las lesiones celíacas; se especula que la presentación de clase I de gliadina, tTG u otros péptidos invoca la señalización. No se conoce el papel del receptor de clase I en la muerte celular programada mediada por células (enterocitos).
Estas proteínas se denominan polipéptidos de clase I del MHC de secuencia A y B. Estas proteínas, descubiertas mediante análisis de homología de secuencias, se encuentran en la superficie de los enterocitos del intestino delgado y se cree que desempeñan un papel en la enfermedad. Los estudios realizados hasta la fecha no han revelado ninguna mutación que aumente el riesgo de contraer MICA.
Las proteínas HLA-DQ presentan regiones polipeptídicas de proteínas de aproximadamente 9 aminoácidos y mayor tamaño (10 a 14 residuos en la unión es común para la gliadina) a los linfocitos T. [16] Las proteínas gliadina pueden ser adsorbidas por APC . Después de la digestión en los lisosomas de las APC, los péptidos de gliadina pueden reciclarse a la superficie de la célula unidos a DQ, o pueden unirse y presentarse directamente desde la superficie celular. [17] La principal fuente de gluten inflamatorio es el gluten dietético. La reactividad óptima de la gliadina ocurre cuando la proteína es parcialmente digerida por la lisozima y la tripsina del intestino delgado en digestos proteolíticos. Estos polipéptidos del gluten pueden luego abrirse camino detrás de la capa epitelial de células (membrana), donde las APC y las células T residen en la lámina propia . (Ver: Condiciones subyacentes).
La APC que lleva el péptido DQ-gliadina en la superficie puede unirse a las células T que tienen un receptor de células T similar a un anticuerpo, el DQ2.5 específicamente reconocido con gliadina. El complejo (APC-DQ-gliadina) estimula así la división de las células T específicas de gliadina. Estas células hacen que las células B que reconocen la gliadina proliferen. Las células B maduran hasta convertirse en células plasmáticas que producen anticuerpos anti-gliadina . Esto no causa enfermedad celíaca y es un factor desconocido en la enfermedad idiopática . Se cree que la enteropatía ocurre cuando la transglutaminasa tisular (tTG) se une de manera colateral a los péptidos de gliadina que ingresan en la lámina propia de las vellosidades intestinales. La estructura resultante puede ser presentada por APC (con la misma gliadina que reconoce las isoformas DQ) a las células T, y las células B pueden producir anticuerpos anti-transglutaminasa . Esto parece resultar en la destrucción de las vellosidades. La liberación de gliadina por la transglutaminasa no disminuye la enfermedad. Cuando la gliadina tTG sufre hidrólisis, el resultado es gliadina desamidada. Los péptidos de gliadina desamidada son más inflamatorios en relación con los péptidos naturales. La gliadina desamidada también se encuentra en alimentos a los que se les ha añadido gluten, como el pan de trigo y las pastas alimenticias.
Las principales proteínas del gluten implicadas en la enfermedad celíaca son las isoformas de α-gliadina. La gliadina alfa está compuesta de motivos repetidos que, cuando se digieren, pueden ser presentados por moléculas HLA-DQ. DQ2.5 reconoce varios motivos en las proteínas del gluten y, por lo tanto, HLA-DQ puede reconocer muchos motivos en cada gliadina (consulte Comprensión de los haplotipos DQ y las isoformas DQ a la derecha) [18] Sin embargo, se ha descubierto que varias proteínas diferentes de la tribu de gramíneas Triticeae llevan motivos presentados por HLA DQ2.5 y DQ8. El trigo tiene una gran cantidad de estas proteínas porque su genoma contiene cromosomas derivados de dos especies de pasto de cabra y una especie primitiva de trigo . [19] [20] Las posiciones de estos motivos en diferentes especies, cepas e isoformas pueden variar debido a inserciones y deleciones en la secuencia. Hay una gran cantidad de variantes de trigo y una gran cantidad de gliadinas en cada variante y, por lo tanto, muchos sitios potenciales. Una vez identificadas y secuenciadas estas proteínas, se pueden estudiar mediante búsquedas de homología de secuencia.
El reconocimiento de gliadina por parte de HLA-DQ es fundamental para la patogénesis de la enteropatía sensible al gluten; también parece estar involucrado en la sensibilidad al gluten idiopática (consulte Comprensión de los haplotipos de DQ y las isoformas de DQ a la derecha). HLA-DQ2 presenta principalmente gliadinas con la isoforma DQ2.5 (DQ α5-β2) de HLA-DQ. Los homocigotos DQA1*0202:DQB1*0201 (DQ α2-β2) también parecen ser capaces de presentar péptidos de gliadina patógenos, pero un conjunto más pequeño con menor afinidad de unión.
Muchos de estos motivos de gliadina son sustratos para la transglutaminasa tisular y, por lo tanto, pueden modificarse mediante desamidación en el intestino para crear más péptidos inflamatorios. El reconocimiento más importante parece estar dirigido hacia las α-/β-gliadinas. Un ejemplo de la repetición de un motivo en muchas proteínas, la gliadina α-2 (57-68) y (62-75) también se encuentran en la gliadina α-4, α-9. [22] Muchas gliadinas contienen el "motivo α-20", que se encuentra en el trigo y otros géneros de Triticeae (ver también: motivos de gliadina "α-20" ). La alfa-2 secalina , la proteína glutinosa del centeno, está compuesta por dos sitios de células T superpuestos en el extremo amino terminal en las posiciones (8-19) y (13-23). [22]

Aunque en la enfermedad celíaca se pueden encontrar respuestas de las células T a muchas prolaminas, una gliadina en particular, la α2-gliadina, parece ser el foco de las células T. [23] Estas respuestas dependían del tratamiento previo con transglutaminasa tisular. La α2-gliadina se diferencia de las otras α-gliadinas, específicamente porque contiene un inserto de 14 aminoácidos. [24] Esta inserción en particular crea seis sitios de células T donde, en las gliadinas más similares, hay dos o menos sitios. Los sitios pertenecen a tres grupos de epítopos "α-I", "α-II" y "α-III" [25] La inserción también crea una región más grande de α-gliadina que es resistente a las proteasas gastrointestinales. El digesto más pequeño de tripsina y quimotripsina para la región es un 33mer . [1] Esta región en particular tiene tres sitios de transglutaminasa tisular, dos sitios que se encuentran dentro de la inserción de 14 aminoácidos, una región de estimulación máxima se encuentra con más del 80% de reducción en la respuesta para la secuencia nativa, no desaminada, en la posición. [26] Debido a la densidad de sitios de células T en el "33mer", la afinidad por la gliadina desamidada indica firmemente que puede ser mejor tratada como un único sitio de células T de mucha mayor afinidad. [1] Este sitio por sí solo puede cumplir con todos los requisitos inmunológicos adaptativos de las células T auxiliares con la participación de HLA-DQ2.5 en algunas enfermedades celíacas.
Si bien la gamma gliadina no es tan importante para la enfermedad mediada por DQ2.5 como la α-2 gliadina, hay varios motivos identificados. Los epítopos gamma identificados son DQ2-"γ-I", -"γ-II" (γ30), -"γ-III", -"γ-IV", -"γ-VI" y -"γ-VII" [27] [28] Algunos de estos epítopos se reconocen en niños que no tienen reactividades de células T hacia la α-2 gliadina. [29] Se ha encontrado un fragmento de resistencia proteolítica de 26 residuos en la γ-5 gliadina, posiciones 26-51, que tiene múltiples epítopos de transglutaminasa y células T. Este sitio tiene cinco sitios de células T superpuestos de DQ2-"γ-II", -"γ-III", -"γ-IV" y "γ-glia 2". [30] El análisis computacional de 156 prolaminas y glutelinas reveló muchos más fragmentos resistentes; uno de ellos, una γ-gliadina, que contenía 4 epítopos tenía una longitud de 68 aminoácidos.
Las glutelinas de Triticeae presentadas por DQ2 son algunas de las celíacas. En el trigo, las gluteninas de bajo peso molecular a menudo comparten una similitud estructural con las prolaminas de especies similares de Triticeae. Se han identificado dos motivos, similar a K1 (46-60), similar a pGH3 (41-59) y GF1 (33-51). La glutenina de alto peso molecular también se ha identificado como una proteína potencialmente tóxica [31]. Algunas de las gluteninas de alto peso molecular aumentan la respuesta con el tratamiento con transglutaminasa, lo que indica que los sitios podrían ser similares a los sitios de células T de alfa-gliadina y gamma-gliadina. [32]
DQ2.2 puede presentar un menor número de sitios de menor afinidad en relación con DQ2.5. Algunos de estos sitios se encuentran en la gliadina γ, la gliadina más similar a las prolaminas de otros géneros Triticeae , una gliadina que parece similar a la ancestral. Las células presentadoras de antígenos que portan DQ2.2 pueden presentar sitios de gliadina alfa, por ejemplo, la región alfa-II del "33mer" y, por lo tanto, el "33mer" puede tener un papel en los individuos que portan DQ2.2, pero la capacidad de unión es sustancialmente menor. [28]
El HLA-DQ8 confiere susceptibilidad a la enfermedad celíaca, pero de una manera similar al DQ2.5. [33] Los homocigotos de DQ8, DQ2.5/DQ8 y DQ8/DQ2.2 son más altos de lo esperado en función de los niveles en la población general (ver: Comprensión de los haplotipos DQ e isoformas DQ). [15] El HLA-DQ8 generalmente no está tan involucrado en las complicaciones más graves y no reconoce el "33mer" de la gliadina α-2 en el mismo grado que el DQ2.5. Hay una menor cantidad de péptidos de gliadina (prolamina) presentados por el HLA-DQ8. Se han realizado algunos estudios sobre la respuesta inmunitaria adaptativa para individuos DQ8/DQ2−. El DQ8 parece depender mucho más de la inmunidad adaptativa a la mitad carboxilo de las gliadinas alfa. [34] Además, parece reaccionar con la gamma gliadina en un grado comparable al DQ2.5. [35] Las respuestas de las células T a la glutenina de alto peso molecular pueden ser más importantes con la enfermedad celíaca mediada por DQ8 que con la mediada por DQ2.5. [31]
El reconocimiento del gluten por anticuerpos es complejo. La unión directa al gluten, como los anticuerpos antigliadina, tiene una patogenia ambigua en la enfermedad celíaca. La reticulación de la gliadina con la transglutaminasa tisular conduce a la producción de anticuerpos antitransglutaminasa, pero esto está mediado por el reconocimiento de la gliadina por parte de las células T. El reconocimiento alérgico de la gliadina por los mastocitos, eosinófilos en presencia de IgE, tiene consecuencias directas notables, como la anafilaxia inducida por el ejercicio .
Los anticuerpos antigliadina, como los detectados en la enfermedad celíaca, se unen a la gliadina α-2 (57–73). [36] Este sitio está dentro del "33mer" reactivo a las células T presentado por DQ2.5. Se ha sugerido que el trigo desempeña un papel en la diabetes juvenil , ya que los anticuerpos contra la glb-1 (una globulina) de almacenamiento de semillas no glutinosas están implicados en anticuerpos autoantigénicos de reactividad cruzada que destruyen las células de los islotes del páncreas. [37] Se han encontrado anticuerpos antigliadina contra la sinapsina I. [38] Los anticuerpos contra la omega-gliadina y la subunidad de glutenina de alto peso molecular se han encontrado con mayor frecuencia en individuos con anafilaxia inducida por el ejercicio y alergia de Baker, y representan una potente clase de alérgenos del gluten. Las proteínas no glutinosas del trigo también son alérgenos, entre ellas: LTP ( albúmina / globulina ), tiorredoxina -hB y peroxidasa de la harina de trigo . [39] [40] [41] [42] Se ha descubierto que un péptido particular de 5 residuos, el motivo Gln-Gln-Gln-Pro-Pro, es un alérgeno importante del trigo. [43]
Casi mensualmente aparecen en la literatura nuevos motivos inmunogénicos y nuevas secuencias de gliadinas y proteínas Triticeae que contienen estos motivos. El péptido restringido HLA DQ2.5 "IIQPQQPAQ" produjo aproximadamente 50 resultados de secuencias idénticas en la búsqueda NCBI-Blast y es uno de varias docenas de motivos conocidos [22], mientras que solo se ha examinado una pequeña fracción de las variantes de gluten de Triticeae. Por esta razón, la inmunoquímica se discute mejor a nivel de Triticeae , porque está claro que las propiedades inmunológicas especiales de las proteínas parecen tener afinidades basales con este taxón, apareciendo concentradas en el trigo como resultado de sus tres genomas diferentes. Algunos estudios actuales afirman que es plausible eliminar la toxicidad de las gliadinas del trigo [44] , pero, como ilustra lo anterior, el problema es monumental. Hay muchas proteínas de gluten, tres genomas con muchos genes cada uno para gliadinas alfa, gamma y omega. Para cada motivo están presentes muchos loci del genoma y hay muchos motivos, algunos aún desconocidos.
Existen diferentes cepas de Triticeae para diferentes aplicaciones industriales: trigo duro para pastas y pastas alimenticias, dos tipos de cebada para cerveza, trigo panificable utilizado en diferentes áreas con diferentes condiciones de cultivo. Reemplazar estos motivos no es una tarea plausible ya que una contaminación de 0,02% de trigo en una dieta sin gluten se considera patógena y requeriría reemplazar los motivos en todas las variedades regionales conocidas, potencialmente miles de modificaciones genéticas. [44] Las respuestas de clase I y de anticuerpos son posteriores al reconocimiento de clase II y tienen poco valor correctivo en el cambio. El péptido de respuesta innata podría ser una bala de plata, suponiendo que solo haya uno de estos por proteína y solo unos pocos loci del genoma con la proteína. Las preguntas sin resolver relevantes para una comprensión completa de las respuestas inmunes al gluten son: ¿Por qué está aumentando rápidamente la tasa de sensibilidad al gluten de aparición tardía? ¿Es esto realmente un problema del trigo, o algo que se le está haciendo al trigo, o a quienes comen trigo (por ejemplo, enfermedades transmisibles como desencadenante)? Algunas personas son susceptibles por genética (aparición temprana), pero muchos casos de aparición tardía podrían tener desencadenantes diferentes porque no hay nada que separe genéticamente al 30 a 40% de las personas que podrían tener sensibilidad a Triticeae del ~1% que, en su vida, tendrá algún nivel de esta enfermedad.
Otra forma de hacer que el trigo sea menos inmunogénico es insertar sitios proteolíticos en los motivos más largos (25-mer y 33-mer), facilitando una digestión más completa.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )