En química física orgánica , la ecuación de Swain-Lupton es una relación lineal de energía libre (LFER) que se utiliza en el estudio de mecanismos de reacción y en el desarrollo de relaciones cuantitativas estructura-actividad de compuestos orgánicos . Fue desarrollado por C. Gardner Swain y Elmer C. Lupton Jr. en 1968 como un refinamiento de la ecuación de Hammett para incluir tanto efectos de campo como efectos de resonancia.
En química orgánica, el diagrama de Hammett proporciona un medio para evaluar los efectos de los sustituyentes en el equilibrio o la velocidad de una reacción utilizando la ecuación de Hammett ( 1 ):
Hammett desarrolló esta ecuación a partir de constantes de equilibrio de la disociación del ácido benzoico y sus derivados (Fig. 1):

Hammett definió la ecuación basándose en dos parámetros: la constante de reacción (ρ) y el parámetro sustituyente (σ). Cuando se estudiaron otras reacciones utilizando estos parámetros, no siempre se encontró una correlación debido a la derivación específica de estos parámetros del equilibrio de disociación de los ácidos benzoicos sustituidos y la negligencia original de los efectos de resonancia. Por lo tanto, los efectos de los sustituyentes en una serie de compuestos deben estudiarse en cada reacción individual utilizando la ecuación derivada de Hammett para los efectos de campo o de resonancia, pero no para ambos.
C. Gardner Swain y Elmer C. Lupton Jr. del Instituto Tecnológico de Massachusetts redefinieron el parámetro sustituyente, σ, basándose en la idea de que no son necesarias más de dos variables (efectos de resonancia y efectos de campo) para describir los efectos de cualquier efecto dado. sustituyente. Los efectos de campo, F , se definen para incluir todos los efectos (campo inductivo y puro). Asimismo, los efectos debidos a la resonancia , R , se deben al promedio de la capacidad de donación de electrones y la capacidad de aceptación de electrones. Se supone que estos dos efectos son independientes entre sí y, por lo tanto, pueden escribirse como una combinación lineal:
Estos dos parámetros se tratan como términos independientes debido al supuesto que hicieron Swain y Lupton; el sustituyente se mantiene alejado por tres o más centros saturados o si el sustituyente es (CH 3 ) 3 N + . Todos los demás términos son entonces insignificantes y conducen a la ecuación de Swain-Lupton ( 2 ).
El parámetro del sustituyente ahora está definido por los efectos de campo y resonancia, F y R , que dependen del sustituyente individual. Las constantes r y f explican la importancia de cada uno de los dos efectos. Estas constantes no dependen del sustituyente sino que dependen del conjunto de parámetros del sustituyente de Hammett (σ m , σ p , σ p+ , σ ' , etc.).
Para encontrar las constantes ponderadas, r y f , para cada conjunto de parámetros de sustituyentes, sería necesario establecer el hecho de que cada nuevo parámetro de sustituyente σ X podría escribirse como una combinación lineal de parámetros de sustituyentes de reacción específicos, es decir
donde σ 1X y σ 2X son parámetros específicos del sustituyente (es decir, σ + , σ − , etc.) y c 1 y c 2 son constantes independientes del sustituyente (dependen de las condiciones de reacción, es decir, temperatura, disolvente y reacción individual que se esté estudiando). ). Esto se puede expresar de manera más genérica como:
donde i es una intersección para evitar fijar el origen en (0,0). Si no se hiciera esto, la ecuación daría mucho más peso a los compuestos no sustituidos con los que se intenta comparar usando esta ecuación. [1] Se utiliza un análisis lineal de mínimos cuadrados para determinar los coeficientes/constantes a , by i (Swain y Lupton utilizaron un procedimiento llamado DOVE: Evaluación de vector obligado dual). [2] Las constantes se basaron primero en tres reacciones previas (σ m , σ p , σ p+ ), lo que conduce a más errores posibles ya que los datos compilados son solo una combinación mínima de un conjunto mucho más grande. Al ver un posible error en este conjunto limitado, se aumentó el conjunto de datos asignando una escala para empezar. Se utiliza una escala cero para el hidrógeno, porque se sabe que no dona ni acepta fácilmente densidad de electrones cuando se une a un átomo de carbono debido a electronegatividades similares. Se asignó un valor de 1 al NO 2 , porque investigaciones anteriores determinaron que el efecto de este sustituyente se debía predominantemente a la resonancia. [3] Por último, F se igualó a R para ambos componentes para que los efectos de campo pudieran compararse directamente con los efectos de resonancia. Esto luego conduce a:
La figura 2 muestra algunos valores relativos de F y R que fundaron Swain y Lupton. [2]
Los grupos alquilo tienen un valor bajo a cero para F pero valores razonables para R. Esto se explica más comúnmente por la hiperconjugación , es decir, poco o ningún efecto inductivo, sino efectos de resonancia parcial.

CF 3 tiene una relación R / F mucho mayor que otros sustituyentes con altos grados de conjugación. Swain estudió esto con mayor detalle, pero aún se explica mejor mediante la hiperconjugación con fluoruro.

Los sustituyentes cargados positivamente (es decir, N(CH 3 ) 3+ y S(CH 3 ) 2+ ) tienen valores F positivos mayores debido a una carga positiva que está saturada cerca de la estructura de carbono en cuestión. Los sustituyentes cargados negativamente (es decir, CO 2− y SO 3− ) tienen valores de F mucho más bajos debido a su capacidad para hacer resonar la densidad electrónica entre los átomos de oxígeno y estabilizarla mediante enlaces de hidrógeno con disolventes.
Las relaciones lineales de energía libre siguen siendo útiles, a pesar de sus desventajas cuando se llevan al límite. "Las nuevas técnicas para resolver los parámetros de los sustituyentes de Swain-Lupton implican el estudio de cambios químicos mediante espectroscopia de resonancia magnética nuclear" . Recientemente, se estudiaron los cambios químicos de 15 N NMR y los efectos sustituyentes de la 1,2,3,4,5,6,7,8-octahidroacridina y sus derivados. Se encontraron valores para R y F para el grupo −N(COCH 3 ) 2 , que no se habían podido encontrar previamente utilizando métodos conocidos. [4]
En ocasiones resulta útil observar el porcentaje de resonancia (% r ), porque r depende de la reacción y es el mismo para todos los sustituyentes.
Se puede predecir la diferencia en los datos comparando dos sustituyentes usando % r :
El efecto más dominante es claro cuando se observa la relación entre R y F. Por ejemplo, se demostró que un complejo de tungsteno alquila carbonatos de alilo A y B. La proporción de los productos A1 y B1 se puede atribuir al sustituyente para, X ( Fig. 3 ). Utilizando los parámetros de Swain-Lupton (σ = 0,2 F + 0,8 R ), se encontró que la pendiente era un valor de ρ de -2,5.
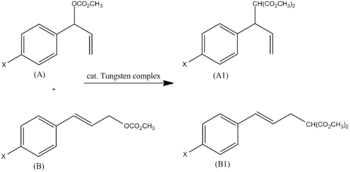

Esto concuerda con el mecanismo propuesto (se forma una carga positiva en el carbono bencílico y se estabiliza mediante resonancia; R domina en una proporción de 0,8/0,2). [5]
Como cualquier otra relación lineal de energía libre establecida, la ecuación de Swain-Lupton también fallará cuando surjan circunstancias especiales, es decir, un cambio en la velocidad que determina el paso de un mecanismo o estructura de solvatación. [6]