
La clonación molecular es un conjunto de métodos experimentales de biología molecular que se utilizan para ensamblar moléculas de ADN recombinante y dirigir su replicación dentro de organismos hospedadores . [1] El uso de la palabra clonación se refiere al hecho de que el método implica la replicación de una molécula para producir una población de células con moléculas de ADN idénticas. La clonación molecular generalmente utiliza secuencias de ADN de dos organismos diferentes: la especie que es la fuente del ADN que se va a clonar y la especie que servirá como hospedador vivo para la replicación del ADN recombinante. Los métodos de clonación molecular son fundamentales para muchas áreas contemporáneas de la biología y la medicina modernas. [2]
En un experimento de clonación molecular convencional, el ADN que se va a clonar se obtiene de un organismo de interés y luego se trata con enzimas en el tubo de ensayo para generar fragmentos de ADN más pequeños. Posteriormente, estos fragmentos se combinan con ADN vector para generar moléculas de ADN recombinante. Luego, el ADN recombinante se introduce en un organismo huésped (normalmente una cepa de laboratorio benigna y fácil de cultivar de la bacteria E. coli ). Esto generará una población de organismos en los que las moléculas de ADN recombinante se replican junto con el ADN huésped. Debido a que contienen fragmentos de ADN extraños, se trata de microorganismos transgénicos o modificados genéticamente ( OGM ). [3] Este proceso aprovecha el hecho de que se puede inducir a una sola célula bacteriana a que absorba y replique una sola molécula de ADN recombinante. Esta única célula puede luego expandirse exponencialmente para generar una gran cantidad de bacterias, cada una de las cuales contiene copias de la molécula recombinante original. Por lo tanto, tanto la población bacteriana resultante como la molécula de ADN recombinante se denominan comúnmente "clones". Estrictamente hablando, el ADN recombinante se refiere a las moléculas de ADN, mientras que la clonación molecular se refiere a los métodos experimentales utilizados para ensamblarlas. Surgió la idea de que se podían insertar diferentes secuencias de ADN en un plásmido y que estas secuencias extrañas serían transportadas a las bacterias y digeridas como parte del plásmido. Es decir, estos plásmidos podrían servir como vectores de clonación para transportar genes. [4]
Prácticamente cualquier secuencia de ADN puede clonarse y amplificarse, pero existen algunos factores que pueden limitar el éxito del proceso. Ejemplos de secuencias de ADN que son difíciles de clonar son las repeticiones invertidas, los orígenes de replicación, los centrómeros y los telómeros. También hay una menor probabilidad de éxito cuando se insertan secuencias de ADN de gran tamaño. Las inserciones de más de 10 kbp tienen un éxito muy limitado, pero los bacteriófagos como el bacteriófago λ pueden modificarse para insertar con éxito una secuencia de hasta 40 kbp. [5]
Antes de la década de 1970, la comprensión de la genética y la biología molecular se vio gravemente obstaculizada por la incapacidad de aislar y estudiar genes individuales de organismos complejos. Esto cambió drásticamente con la llegada de los métodos de clonación molecular. Los microbiólogos, que buscaban comprender los mecanismos moleculares a través de los cuales las bacterias restringían el crecimiento de los bacteriófagos, aislaron endonucleasas de restricción , enzimas que podían escindir moléculas de ADN solo cuando se encontraban secuencias de ADN específicas. [6] Demostraron que las enzimas de restricción escindían moléculas de ADN de longitud cromosómica en ubicaciones específicas, y que secciones específicas de la molécula más grande podían purificarse mediante fraccionamiento por tamaño. Usando una segunda enzima, la ADN ligasa , los fragmentos generados por las enzimas de restricción podían unirse en nuevas combinaciones, denominadas ADN recombinante . Al recombinar segmentos de ADN de interés con ADN vectorial, como bacteriófagos o plásmidos, que se replican naturalmente dentro de las bacterias, se podían producir grandes cantidades de moléculas de ADN recombinante purificadas en cultivos bacterianos. Las primeras moléculas de ADN recombinante se generaron y estudiaron en 1972. [7] [8]
La clonación molecular aprovecha el hecho de que la estructura química del ADN es básicamente la misma en todos los organismos vivos. Por lo tanto, si cualquier segmento de ADN de cualquier organismo se inserta en un segmento de ADN que contiene las secuencias moleculares necesarias para la replicación del ADN , y el ADN recombinante resultante se introduce en el organismo del que se obtuvieron las secuencias de replicación, entonces el ADN extraño se replicará junto con el ADN de la célula huésped en el organismo transgénico .
La clonación molecular es similar a la PCR en el sentido de que permite la replicación de la secuencia de ADN. La diferencia fundamental entre ambos métodos es que la clonación molecular implica la replicación del ADN en un microorganismo vivo, mientras que la PCR replica el ADN en una solución in vitro , libre de células vivas.
Antes de que se realicen los experimentos de clonación reales en el laboratorio, la mayoría de los experimentos de clonación se planifican en una computadora, utilizando un software especializado. Aunque la planificación detallada de la clonación se puede realizar en cualquier editor de texto, junto con utilidades en línea para, por ejemplo, el diseño de cebadores de PCR, existe software dedicado para este propósito. El software para este propósito incluye, por ejemplo, ApE [1] (código abierto), DNAStrider [2] (código abierto), Serial Cloner [3] (gratis), Collagene [4] (código abierto) y SnapGene (comercial). Estos programas permiten simular reacciones de PCR , digestos de restricción , ligaciones , etc., es decir, todos los pasos descritos a continuación.
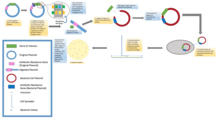
En los experimentos estándar de clonación molecular, la clonación de cualquier fragmento de ADN implica esencialmente siete pasos: (1) Elección del organismo huésped y del vector de clonación, (2) Preparación del ADN del vector, (3) Preparación del ADN que se va a clonar, (4) Creación de ADN recombinante, (5) Introducción de ADN recombinante en el organismo huésped, (6) Selección de organismos que contienen ADN recombinante, (7) Selección de clones con insertos de ADN y propiedades biológicas deseadas.
Cabe destacar que la creciente capacidad y fidelidad de las plataformas de síntesis de ADN permite diseños cada vez más complejos en ingeniería molecular. Estos proyectos pueden incluir cadenas muy largas de secuencias de ADN nuevas o probar bibliotecas completas simultáneamente, en lugar de secuencias individuales. Estos cambios introducen una complejidad que requiere que el diseño se aleje de la representación plana basada en nucleótidos y avance hacia un nivel más alto de abstracción. Ejemplos de tales herramientas son GenoCAD , Teselagen [5] (gratis para académicos) o GeneticConstructor [6] (gratis para académicos).

Aunque se utilizan una gran cantidad de organismos hospedadores y vectores de clonación molecular, la gran mayoría de los experimentos de clonación molecular comienzan con una cepa de laboratorio de la bacteria E. coli ( Escherichia coli ) y un vector de clonación plasmídica . La E. coli y los vectores plasmídicos son de uso común porque son técnicamente sofisticados, versátiles, están ampliamente disponibles y ofrecen un crecimiento rápido de organismos recombinantes con un equipo mínimo. [3] Si el ADN que se va a clonar es excepcionalmente grande (cientos de miles a millones de pares de bases), entonces a menudo se elige un cromosoma artificial bacteriano [10] o un vector de cromosoma artificial de levadura .
Las aplicaciones especializadas pueden requerir sistemas de hospedador-vector especializados. Por ejemplo, si los investigadores desean extraer una proteína particular del organismo recombinante, se elige un vector de expresión que contenga señales apropiadas para la transcripción y traducción en el organismo hospedador deseado. Alternativamente, si se desea la replicación del ADN en diferentes especies (por ejemplo, transferencia de ADN de bacterias a plantas), se puede seleccionar un vector de hospedador múltiple (también denominado vector lanzadera ). Sin embargo, en la práctica, los experimentos especializados de clonación molecular suelen comenzar con la clonación en un plásmido bacteriano, seguida de la subclonación en un vector especializado.
Cualquiera que sea la combinación de huésped y vector que se utilice, el vector casi siempre contiene cuatro segmentos de ADN que son de importancia crítica para su función y utilidad experimental: [3]

El vector de clonación se trata con una endonucleasa de restricción para escindir el ADN en el sitio donde se insertará el ADN extraño. La enzima de restricción se elige para generar una configuración en el sitio de escisión que sea compatible con los extremos del ADN extraño (ver extremo del ADN ). Normalmente, esto se hace escindiendo el ADN del vector y el ADN extraño con la misma enzima de restricción o endonucleasa de restricción, por ejemplo EcoRI y esta enzima de restricción se aisló de E. coli. [11] La mayoría de los vectores modernos contienen una variedad de sitios de escisión convenientes que son únicos dentro de la molécula del vector (de modo que el vector solo se puede escindir en un solo sitio) y se encuentran dentro de un gen (frecuentemente beta-galactosidasa ) cuya inactivación se puede utilizar para distinguir organismos recombinantes de no recombinantes en un paso posterior del proceso. Para mejorar la proporción de organismos recombinantes a no recombinantes, el vector escindido puede tratarse con una enzima ( fosfatasa alcalina ) que desfosforila los extremos del vector. Las moléculas vectoriales con extremos desfosforilados no pueden replicarse, y la replicación solo puede restaurarse si se integra ADN extraño en el sitio de escisión. [12]

Para la clonación de ADN genómico, el ADN que se va a clonar se extrae del organismo de interés. Se puede utilizar prácticamente cualquier fuente de tejido (incluso tejidos de animales extintos ), [13] siempre que el ADN no esté degradado de forma extensa. A continuación, el ADN se purifica utilizando métodos sencillos para eliminar las proteínas contaminantes (extracción con fenol), el ARN (ribonucleasa) y moléculas más pequeñas (precipitación y/o cromatografía). Los métodos de reacción en cadena de la polimerasa (PCR) se utilizan a menudo para la amplificación de secuencias específicas de ADN o ARN ( RT-PCR ) antes de la clonación molecular.
El ADN para experimentos de clonación también puede obtenerse a partir de ARN utilizando transcriptasa inversa ( clonación de ADN complementario o ADNc), o en forma de ADN sintético ( síntesis genética artificial ). La clonación de ADNc se utiliza habitualmente para obtener clones representativos de la población de ARNm de las células de interés, mientras que el ADN sintético se utiliza para obtener cualquier secuencia precisa definida por el diseñador. Una secuencia diseñada de este tipo puede ser necesaria cuando se mueven genes a través de códigos genéticos (por ejemplo, de las mitocondrias al núcleo) [14] o simplemente para aumentar la expresión mediante la optimización de codones . [15]
El ADN purificado se trata luego con una enzima de restricción para generar fragmentos con extremos capaces de unirse a los del vector. Si es necesario, se pueden agregar segmentos cortos de doble cadena de ADN ( enlazadores ) que contengan los sitios de restricción deseados para crear estructuras finales que sean compatibles con el vector. [3] [12]
La creación de ADN recombinante es, en muchos sentidos, el paso más simple del proceso de clonación molecular. El ADN preparado a partir del vector y de la fuente extraña simplemente se mezclan en concentraciones apropiadas y se exponen a una enzima ( ADN ligasa ) que une los extremos de forma covalente. Esta reacción de unión se denomina a menudo ligación . La mezcla de ADN resultante que contiene extremos unidos aleatoriamente está lista para su introducción en el organismo huésped.
La ADN ligasa sólo reconoce y actúa sobre los extremos de las moléculas de ADN lineales, lo que normalmente da como resultado una mezcla compleja de moléculas de ADN con extremos unidos aleatoriamente. Los productos deseados (ADN del vector unido covalentemente a ADN extraño) estarán presentes, pero otras secuencias (por ejemplo, ADN extraño unido a sí mismo, ADN del vector unido a sí mismo y combinaciones de orden superior de ADN del vector y extraño) también suelen estar presentes. Esta mezcla compleja se clasifica en pasos posteriores del proceso de clonación, después de que la mezcla de ADN se introduce en las células. [3] [12]
La mezcla de ADN, previamente manipulada in vitro, se vuelve a introducir en una célula viva, denominada organismo huésped. Los métodos utilizados para introducir el ADN en las células son variados y el nombre que se aplica a este paso del proceso de clonación molecular dependerá a menudo del método experimental elegido (por ejemplo, transformación , transducción , transfección , electroporación ). [3] [12]
Cuando los microorganismos son capaces de captar y replicar ADN de su entorno local, el proceso se denomina transformación , y las células que están en un estado fisiológico tal que pueden captar ADN se dice que son competentes . [16] En el cultivo de células de mamíferos, el proceso análogo de introducir ADN en las células se denomina comúnmente transfección . Tanto la transformación como la transfección suelen requerir la preparación de las células a través de un régimen de crecimiento especial y un proceso de tratamiento químico que variará según las especies específicas y los tipos de células que se utilicen.
La electroporación utiliza pulsos eléctricos de alto voltaje para trasladar el ADN a través de la membrana celular (y la pared celular, si está presente). [17] En cambio, la transducción implica el empaquetamiento del ADN en partículas derivadas de virus y el uso de estas partículas similares a virus para introducir el ADN encapsulado en la célula a través de un proceso similar a una infección viral. Aunque la electroporación y la transducción son métodos altamente especializados, pueden ser los métodos más eficientes para trasladar el ADN a las células.
Cualquiera que sea el método utilizado, la introducción de ADN recombinante en el organismo huésped elegido suele ser un proceso de baja eficiencia; es decir, sólo una pequeña fracción de las células captará realmente el ADN. Los científicos experimentales abordan esta cuestión mediante un paso de selección genética artificial, en el que las células que no han captado ADN son eliminadas selectivamente, y sólo las células que pueden replicar activamente el ADN que contiene el gen marcador seleccionable codificado por el vector son capaces de sobrevivir. [3] [12]
Cuando se utilizan células bacterianas como organismos hospedadores, el marcador seleccionable suele ser un gen que confiere resistencia a un antibiótico que de otro modo mataría a las células, normalmente la ampicilina . Las células que albergan el plásmido sobrevivirán cuando se expongan al antibiótico, mientras que las que no hayan podido captar secuencias del plásmido morirán. Cuando se utilizan células de mamíferos (por ejemplo, células humanas o de ratón), se utiliza una estrategia similar, excepto que el gen marcador (en este caso, normalmente codificado como parte del casete kanMX ) confiere resistencia al antibiótico Geneticin .
Los vectores de clonación bacterianos modernos (por ejemplo, pUC19 y derivados posteriores, incluidos los vectores pGEM) utilizan el sistema de detección azul-blanco para distinguir las colonias (clones) de células transgénicas de las que contienen el vector parental (es decir, ADN del vector sin secuencia recombinante insertada). En estos vectores, el ADN extraño se inserta en una secuencia que codifica una parte esencial de la beta-galactosidasa , una enzima cuya actividad da como resultado la formación de una colonia de color azul en el medio de cultivo que se utiliza para este trabajo. La inserción del ADN extraño en la secuencia codificante de la beta-galactosidasa desactiva la función de la enzima, de modo que las colonias que contienen ADN transformado permanecen incoloras (blancas). Por lo tanto, los experimentadores pueden identificar fácilmente y realizar estudios adicionales sobre clones bacterianos transgénicos, mientras que ignoran aquellos que no contienen ADN recombinante.
La población total de clones individuales obtenidos en un experimento de clonación molecular se denomina a menudo biblioteca de ADN . Las bibliotecas pueden ser muy complejas (como cuando se clona ADN genómico completo de un organismo) o relativamente simples (como cuando se traslada un fragmento de ADN previamente clonado a un plásmido diferente), pero casi siempre es necesario examinar varios clones diferentes para asegurarse de obtener la construcción de ADN deseada. Esto se puede lograr mediante una amplia gama de métodos experimentales, incluido el uso de hibridaciones de ácidos nucleicos , sondas de anticuerpos , reacción en cadena de la polimerasa , análisis de fragmentos de restricción y/o secuenciación de ADN . [3] [12]
La clonación molecular proporciona a los científicos una cantidad prácticamente ilimitada de segmentos individuales de ADN derivados de cualquier genoma. Este material se puede utilizar para una amplia gama de propósitos, incluidos los de la ciencia biológica básica y aplicada. A continuación se resumen algunas de las aplicaciones más importantes.
La clonación molecular ha conducido directamente a la elucidación de la secuencia completa de ADN de los genomas de un gran número de especies y a una exploración de la diversidad genética dentro de especies individuales, trabajo que se ha realizado principalmente determinando la secuencia de ADN de un gran número de fragmentos clonados aleatoriamente del genoma y ensamblando las secuencias superpuestas.
A nivel de genes individuales, los clones moleculares se utilizan para generar sondas que se utilizan para examinar cómo se expresan los genes y cómo esa expresión se relaciona con otros procesos en biología, incluido el entorno metabólico, las señales extracelulares, el desarrollo, el aprendizaje, la senescencia y la muerte celular. Los genes clonados también pueden proporcionar herramientas para examinar la función biológica y la importancia de genes individuales, al permitir a los investigadores inactivar los genes o realizar mutaciones más sutiles utilizando mutagénesis regional o mutagénesis dirigida al sitio . Los genes clonados en vectores de expresión para la clonación funcional proporcionan un medio para detectar genes sobre la base de la función de la proteína expresada.
La obtención del clon molecular de un gen puede conducir al desarrollo de organismos que produzcan el producto proteico de los genes clonados, denominado proteína recombinante. En la práctica, con frecuencia resulta más difícil desarrollar un organismo que produzca una forma activa de la proteína recombinante en cantidades deseables que clonar el gen. Esto se debe a que las señales moleculares para la expresión génica son complejas y variables, y a que el plegamiento, la estabilidad y el transporte de proteínas pueden ser muy difíciles.
Actualmente, se encuentran disponibles muchas proteínas útiles como productos recombinantes . Entre ellas se incluyen: (1) proteínas médicamente útiles cuya administración puede corregir un gen defectuoso o mal expresado (p. ej. , el factor VIII recombinante , un factor de coagulación sanguínea deficiente en algunas formas de hemofilia , [18] y la insulina recombinante , utilizada para tratar algunas formas de diabetes [19] ), (2) proteínas que se pueden administrar para ayudar en una emergencia potencialmente mortal (p. ej. , el activador tisular del plasminógeno , utilizado para tratar accidentes cerebrovasculares [20] ), (3) vacunas de subunidades recombinantes, en las que se puede utilizar una proteína purificada para inmunizar a los pacientes contra enfermedades infecciosas, sin exponerlos al agente infeccioso en sí (p. ej., la vacuna contra la hepatitis B [21] ), y (4) proteínas recombinantes como material estándar para pruebas de laboratorio de diagnóstico.
Una vez caracterizados y manipulados para proporcionar señales para la expresión apropiada, los genes clonados pueden insertarse en organismos, generando organismos transgénicos, también denominados organismos genéticamente modificados (OGM). Aunque la mayoría de los OGM se generan con fines de investigación biológica básica (véase, por ejemplo, el ratón transgénico ), se han desarrollado varios OGM para uso comercial, que van desde animales y plantas que producen fármacos u otros compuestos ( pharming ), plantas de cultivo resistentes a herbicidas y peces tropicales fluorescentes ( GloFish ) para entretenimiento en el hogar. [1]
La terapia génica consiste en suministrar un gen funcional a células que carecen de esa función, con el objetivo de corregir un trastorno genético o una enfermedad adquirida. La terapia génica se puede dividir en dos categorías. La primera es la alteración de las células germinales, es decir, los espermatozoides o los óvulos, que da lugar a un cambio genético permanente para todo el organismo y las generaciones posteriores. Esta "terapia génica de la línea germinal" es considerada por muchos como poco ética en los seres humanos. [22] El segundo tipo de terapia génica, la "terapia génica de células somáticas", es análoga a un trasplante de órganos. En este caso, se trata directamente uno o más tejidos específicos o se elimina el tejido, se añade el gen o los genes terapéuticos en el laboratorio y se devuelven las células tratadas al paciente. Los ensayos clínicos de la terapia génica de células somáticas comenzaron a finales de los años 1990, principalmente para el tratamiento de cánceres y trastornos de la sangre, el hígado y los pulmones. [23]
A pesar de la gran publicidad y las promesas, la historia de la terapia génica humana se ha caracterizado por un éxito relativamente limitado. [23] El efecto de introducir un gen en las células a menudo promueve sólo un alivio parcial y/o transitorio de los síntomas de la enfermedad que se está tratando. Algunos pacientes de ensayos de terapia génica han sufrido consecuencias adversas del propio tratamiento, incluidas las muertes. En algunos casos, los efectos adversos son resultado de la alteración de genes esenciales dentro del genoma del paciente por inactivación insercional. En otros, los vectores virales utilizados para la terapia génica han sido contaminados con virus infecciosos. Sin embargo, la terapia génica todavía se considera un área prometedora de la medicina futura, y es un área en la que hay un nivel significativo de actividad de investigación y desarrollo.