La ADN ligasa es un tipo de enzima que facilita la unión de las cadenas de ADN entre sí al catalizar la formación de un enlace fosfodiéster . Desempeña un papel en la reparación de roturas de cadena sencilla en el ADN dúplex en organismos vivos, pero algunas formas (como la ADN ligasa IV ) pueden reparar específicamente roturas de cadena doble (es decir, una rotura en ambas cadenas complementarias de ADN). Las roturas de cadena sencilla son reparadas por la ADN ligasa utilizando la cadena complementaria de la doble hélice como plantilla, [1] y la ADN ligasa crea el enlace fosfodiéster final para reparar completamente el ADN.
La ADN ligasa se utiliza tanto en la reparación del ADN como en la replicación del ADN (véase Ligasas de mamíferos ). Además, la ADN ligasa tiene un uso extensivo en laboratorios de biología molecular para experimentos de ADN recombinante (véase Aplicaciones de investigación ). La ADN ligasa purificada se utiliza en la clonación de genes para unir moléculas de ADN y formar ADN recombinante .
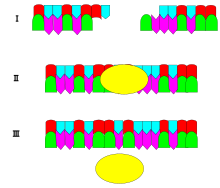
El mecanismo de la ADN ligasa consiste en formar dos enlaces fosfodiéster covalentes entre los extremos hidroxilo 3' de un nucleótido ("aceptor") y el extremo fosfato 5' de otro ("donante"). Se consumen dos moléculas de ATP por cada enlace fosfodiéster formado. [ cita requerida ] El AMP es necesario para la reacción de la ligasa, que se desarrolla en cuatro pasos:
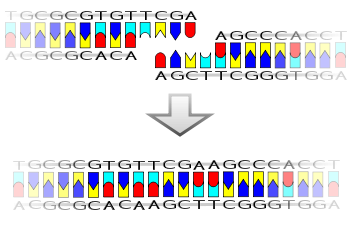
La ligasa también funcionará con extremos romos , aunque se requieren concentraciones de enzima más altas y condiciones de reacción diferentes.
La ligasa de ADN de E. coli está codificada por el gen lig . La ligasa de ADN en E. coli , así como en la mayoría de los procariotas, utiliza la energía obtenida al escindir el dinucleótido de nicotinamida y adenina (NAD) para crear el enlace fosfodiéster. [3] No liga el ADN de extremos romos excepto en condiciones de aglomeración molecular con polietilenglicol , y no puede unir ARN al ADN de manera eficiente. [ cita requerida ]
La actividad de la ADN ligasa de E. coli puede ser potenciada por la ADN polimerasa en las concentraciones adecuadas. La potenciación sólo funciona cuando las concentraciones de la ADN polimerasa 1 son mucho menores que los fragmentos de ADN que se van a ligar. Cuando las concentraciones de las ADN polimerasas Pol I son mayores, esto tiene un efecto adverso sobre la ADN ligasa de E. coli [4]
La ligasa de ADN del bacteriófago T4 (un bacteriófago que infecta a la bacteria Escherichia coli ). La ligasa T4 es la más utilizada en la investigación de laboratorio. [5] Puede ligar extremos cohesivos o romos de ADN, oligonucleótidos, así como ARN e híbridos ARN-ADN, pero no ácidos nucleicos monocatenarios. También puede ligar ADN de extremos romos con mucha mayor eficiencia que la ligasa de ADN de E. coli . A diferencia de la ligasa de ADN de E. coli , la ligasa de ADN T4 no puede utilizar NAD y tiene un requisito absoluto de ATP como cofactor. Se han realizado algunas modificaciones para mejorar la actividad in vitro de la ligasa de ADN T4; un enfoque exitoso, por ejemplo, probó la ligasa de ADN T4 fusionada a varias proteínas de unión de ADN alternativas y descubrió que las construcciones con p50 o NF-kB como socios de fusión eran más del 160% más activas en ligaduras de extremos romos para fines de clonación que la ligasa de ADN T4 de tipo salvaje. [6] Una reacción típica para insertar un fragmento en un vector plasmídico utilizaría aproximadamente entre 0,01 (extremos pegajosos) y 1 (extremos romos) unidades de ligasa. La temperatura de incubación óptima para la ADN ligasa T4 es de 16 °C. [ cita requerida ]
Los mutantes de la ligasa del bacteriófago T4 tienen una mayor sensibilidad tanto a la radiación UV [7] [8] como al agente alquilante metilmetanosulfonato [9], lo que indica que la ADN ligasa se emplea en la reparación de los daños en el ADN causados por estos agentes.
En los mamíferos, hay cuatro tipos específicos de ligasa.
La ADN ligasa de los eucariotas y algunos microbios utiliza trifosfato de adenosina (ATP) en lugar de NAD. [3]
La enzima, derivada de una bacteria termófila, es estable y activa a temperaturas mucho más altas que las ligasas de ADN convencionales. Su vida media es de 48 horas a 65 °C y mayor de 1 hora a 95 °C. Se ha demostrado que la ligasa de ADN Ampligase es activa durante al menos 500 ciclos térmicos (94 °C/80 °C) o 16 horas de ciclo. 10 Esta termoestabilidad excepcional permite una rigurosidad de hibridación y una especificidad de ligación extremadamente altas. [11]
Existen al menos tres unidades diferentes que se utilizan para medir la actividad de la ADN ligasa: [12]
Las ligasas de ADN se han convertido en herramientas indispensables en la investigación de biología molecular moderna para generar secuencias de ADN recombinante . Por ejemplo, las ligasas de ADN se utilizan con enzimas de restricción para insertar fragmentos de ADN, a menudo genes , en plásmidos .
Controlar la temperatura óptima es un aspecto vital para realizar experimentos de recombinación eficientes que involucran la ligadura de fragmentos con extremos cohesivos. La mayoría de los experimentos utilizan la ADN ligasa T4 (aislada del bacteriófago T4 ), que es más activa a 37 °C. [13] Sin embargo, para una eficiencia de ligadura óptima con fragmentos con extremos cohesivos ("extremos pegajosos"), la temperatura óptima de la enzima debe equilibrarse con la temperatura de fusión T m de los extremos pegajosos que se están ligando, [14] el apareamiento homólogo de los extremos pegajosos no será estable porque la alta temperatura interrumpe el enlace de hidrógeno . Una reacción de ligadura es más eficiente cuando los extremos pegajosos ya están recocidos de manera estable y, por lo tanto, la interrupción de los extremos de recocido daría como resultado una baja eficiencia de ligadura. Cuanto más corto sea el voladizo , menor será la T m .
Dado que los fragmentos de ADN con extremos romos no tienen extremos cohesivos para hibridar, la temperatura de fusión no es un factor a considerar dentro del rango de temperatura normal de la reacción de ligación. El factor limitante en la ligación de extremos romos no es la actividad de la ligasa sino más bien el número de alineaciones entre los extremos de los fragmentos de ADN que ocurren. Por lo tanto, la temperatura de ligación más eficiente para el ADN con extremos romos sería la temperatura a la que se pueda producir el mayor número de alineaciones. La mayoría de las ligaciones de extremos romos se llevan a cabo a 14-25 °C durante la noche. La ausencia de extremos hibridados de manera estable también significa que la eficiencia de la ligación se reduce, lo que requiere el uso de una mayor concentración de ligasa. [14]
Un uso novedoso de la ligasa de ADN se puede observar en el campo de la nanoquímica, específicamente en el origami de ADN. Los principios de autoensamblaje basados en ADN han demostrado ser útiles para organizar objetos a escala nanométrica, como biomoléculas, nanomáquinas, componentes nanoelectrónicos y fotónicos. El ensamblaje de dicha nanoestructura requiere la creación de una intrincada malla de moléculas de ADN. Aunque el autoensamblaje de ADN es posible sin ninguna ayuda externa utilizando diferentes sustratos, como la provisión de una superficie catatónica de papel de aluminio, la ligasa de ADN puede proporcionar la asistencia enzimática que se requiere para crear una estructura reticular de ADN a partir de los salientes de ADN. [15]
La primera ligasa de ADN fue purificada y caracterizada en 1967 por los laboratorios Gellert, Lehman, Richardson y Hurwitz. [16] Fue purificada y caracterizada por primera vez por Weiss y Richardson utilizando un proceso de fraccionamiento cromatográfico de seis pasos que comenzó con la eliminación de restos celulares y la adición de estreptomicina, seguido de varios lavados de columna de dietilaminoetil (DEAE)-celulosa y un fraccionamiento final con fosfocelulosa. El extracto final contenía el 10% de la actividad registrada inicialmente en el medio de E. coli ; a lo largo del proceso se descubrió que ATP y Mg++ eran necesarios para optimizar la reacción. Las ligasas de ADN disponibles comercialmente comunes se descubrieron originalmente en el bacteriófago T4 , E. coli y otras bacterias . [17]
Las deficiencias genéticas en las ligasas de ADN humanas se han asociado con síndromes clínicos marcados por inmunodeficiencia, sensibilidad a la radiación y anomalías del desarrollo. [16] El síndrome LIG4 (síndrome de la ligasa IV) es una enfermedad rara asociada con mutaciones en la ligasa de ADN 4 e interfiere con los mecanismos de reparación de roturas del dsADN. El síndrome de la ligasa IV causa inmunodeficiencia en individuos y se asocia comúnmente con microcefalia e hipoplasia de la médula ósea. [18] A continuación, se presenta una lista de enfermedades prevalentes causadas por la falta o el mal funcionamiento de la ligasa de ADN.
El xeroderma pigmentoso , comúnmente conocido como XP, es una enfermedad hereditaria que se caracteriza por una sensibilidad extrema a los rayos ultravioleta (UV) de la luz solar. Esta enfermedad afecta principalmente a los ojos y las zonas de la piel expuestas al sol. Algunas personas afectadas también tienen problemas que afectan al sistema nervioso. [19]
Las mutaciones en el gen ATM causan ataxia-telangiectasia . El gen ATM proporciona instrucciones para producir una proteína que ayuda a controlar la división celular y está involucrada en la reparación del ADN. Esta proteína desempeña un papel importante en el desarrollo y la actividad normales de varios sistemas corporales, incluidos el sistema nervioso y el sistema inmunológico. La proteína ATM ayuda a las células a reconocer las cadenas de ADN dañadas o rotas y coordina la reparación del ADN activando enzimas que reparan las cadenas rotas. La reparación eficiente de las cadenas de ADN dañadas ayuda a mantener la estabilidad de la información genética de la célula. Los niños afectados suelen desarrollar dificultad para caminar, problemas con el equilibrio y la coordinación de las manos, movimientos espasmódicos involuntarios (corea), espasmos musculares (mioclono) y alteraciones en la función nerviosa (neuropatía). Los problemas de movimiento suelen hacer que las personas necesiten asistencia en silla de ruedas en la adolescencia. Las personas con este trastorno también tienen dificultad para hablar y problemas para mover los ojos para mirar de un lado a otro (apraxia oculomotora). [20]
La anemia de Fanconi (AF) es un trastorno sanguíneo hereditario poco frecuente que provoca insuficiencia de la médula ósea. La AF impide que la médula ósea produzca suficientes células sanguíneas nuevas para que el cuerpo funcione con normalidad. La AF también puede hacer que la médula ósea produzca muchas células sanguíneas defectuosas. Esto puede provocar problemas de salud graves, como leucemia . [21]
El síndrome de Bloom provoca una piel sensible a la exposición al sol y, por lo general, la aparición de una mancha enrojecida en forma de mariposa en la nariz y las mejillas. También puede aparecer una erupción cutánea en otras zonas que suelen estar expuestas al sol, como el dorso de las manos y los antebrazos. En la erupción suelen aparecer pequeños grupos de vasos sanguíneos agrandados (telangiectasias); también pueden aparecer telangiectasias en los ojos. Otras características cutáneas incluyen manchas de piel que son más claras o más oscuras que las zonas circundantes (hipopigmentación o hiperpigmentación respectivamente). Estas manchas aparecen en zonas de la piel que no están expuestas al sol y su desarrollo no está relacionado con las erupciones.
En estudios recientes, la ligasa I de ADN humana se utilizó en el diseño de fármacos asistido por ordenador para identificar inhibidores de la ligasa de ADN como posibles agentes terapéuticos para tratar el cáncer. [22] Dado que el crecimiento excesivo de células es un sello distintivo del desarrollo del cáncer, la quimioterapia dirigida que altera el funcionamiento de la ligasa de ADN puede impedir las formas adyuvantes del cáncer. Además, se ha demostrado que las ligasas de ADN se pueden dividir en dos categorías, a saber, dependientes de ATP y NAD + . Investigaciones anteriores han demostrado que, aunque se han descubierto ligasas de ADN dependientes de NAD + en nichos celulares o virales esporádicos fuera del dominio bacteriano de la vida, no hay ningún caso en el que una ligasa dependiente de NAD + esté presente en un organismo eucariota . La presencia únicamente en organismos no eucariotas, la especificidad única del sustrato y la estructura distintiva del dominio de las ligasas de ADN humanas dependientes de NAD+ en comparación con las dependientes de ATP hacen que las ligasas dependientes de NAD + sean objetivos ideales para el desarrollo de nuevos fármacos antibacterianos. [16]