Los agonistas del receptor 5-HT 2C son una clase de fármacos que activan los receptores 5-HT 2C . Se han investigado para el tratamiento de una serie de afecciones, entre ellas la obesidad , los trastornos psiquiátricos , la disfunción sexual y la incontinencia urinaria . [1] [2] [3] [4] [5]
Los receptores 5-HT 2C son uno de los tres subtipos que pertenecen a la subfamilia de receptores de serotonina 5-HT 2 junto con los receptores 5-HT 2A y 5-HT 2B . El desarrollo de agonistas 5-HT 2C ha sido un gran obstáculo, debido a los graves efectos secundarios debido a la falta de selectividad sobre los receptores 5-HT 2A y 5-HT 2B . La activación de los receptores 5-HT 2A puede inducir alucinaciones, y la activación de los receptores 5-HT 2B se ha relacionado con la insuficiencia valvular cardíaca y posiblemente con la hipertensión pulmonar. [6] [7]
A finales de los años 1960, los antagonistas no selectivos del receptor de serotonina demostraron una relación entre los receptores de serotonina y la ingesta de alimentos. Más tarde, los estudios en animales mostraron que los agonistas del receptor de serotonina podrían actuar como mediadores de la saciedad. [8] La serotonina se ha implicado como un factor crítico en la regulación a corto plazo de la ingesta de alimentos y en la promoción de la pérdida de peso asociada con la hiperfagia . [9] Los estudios que utilizan herramientas farmacológicas y genéticas demostraron que el subtipo de receptor 5-HT 2C era uno de los principales mediadores a través de los cuales la serotonina ejerce sus efectos anoréxicos en roedores. Posteriormente, estos receptores se convirtieron en un objetivo farmacoterapéutico prometedor para una mayor investigación para el tratamiento de la obesidad. [10] El desarrollo de ratones knock out del receptor 5-HT 2C a mediados de los años 1990 fue un logro distintivo en la identificación y el desarrollo de fármacos serotoninérgicos para la pérdida de peso. Estos ratones knock out eran hiperfágicos , lo que llevó a la obesidad, resistencia parcial a la leptina , aumento de la deposición adiposa, resistencia a la insulina y alteración de la tolerancia a la glucosa. Como resultado de estos síntomas, los investigadores identificaron un papel funcional para los receptores en la regulación serotoninérgica de la ingesta de alimentos y el peso corporal. [7] [11] Más tarde, los receptores 5-HT 2C se propusieron como un objetivo terapéutico para el tratamiento de múltiples trastornos del sistema nervioso central (SNC), incluidos: trastornos psiquiátricos, obesidad, disfunción sexual e incontinencia urinaria. [9]
El agonista del receptor 5-HT2c Fenfluramina (nombres comerciales Pondimin, Ponderax y Adifax) fue descubierto en 1972 como resultado de la investigación realizada para identificar compuestos anoréxicos que carecieran de los efectos de los psicoestimulantes y agentes simpaticomiméticos (como las anfetaminas). Antes del descubrimiento de la fenfluramina, las anfetaminas eran la forma principal de fármacos anoréxicos disponibles, sin embargo, los efectos secundarios dificultaban su uso. El efecto anoréxico de la fenfluramina se logra a través de un aumento en los niveles de serotonina, lo que imparte una sensación de saciedad, lo que conduce a una menor ingesta de alimentos. La fenfluramina se vendió como una mezcla racémica de dos enantiómeros , dexfenfluramina y levofenfluramina . [12] [13]
En 1994, las ventas del fármaco combinado Fen-phen ( fenfluramina y fentermina ) aumentaron drásticamente, ya que esta combinación produjo un efecto sinérgico sustancial y aparente en la promoción de la pérdida de peso. Posteriormente, los informes de efectos secundarios graves asociados con anomalías de la válvula cardíaca y un mayor riesgo de hipertensión pulmonar dieron lugar a la decisión de retirar los productos que contenían fenfluramina del mercado estadounidense y luego de otros mercados de todo el mundo. [14] [15] [16]
La dexfenfluramina inhibe la recaptación de serotonina , estimulando la liberación de serotonina. En 1996, la dexfenfluramina se convirtió en el primer medicamento antiobesidad de tratamiento a largo plazo aprobado en los EE. UU.; los efectos adversos observados durante los ensayos clínicos incluyeron sequedad de boca, diarrea y somnolencia. A mediados de la década de 1990, la FDA de los EE. UU. aprobó la dexfenfluramina como medicamento para bajar de peso. Después de varios informes de efectos cardiovasculares adversos, la FDA prohibió la dexfenfluramina en 1997. [12] [17] [18]
Parece que los receptores 5-HT 2B , expresados en las válvulas cardíacas, son responsables de las valvulopatías reportadas por el uso de fenfluramina y dexfenfluramina. [19]
El agonista del receptor de serotonina mCPP tiene una afinidad significativa por los receptores 5-HT 2C . Los pacientes con mCPP experimentan múltiples efectos secundarios debido a la falta de selectividad por los receptores 5-HT 2A y 5-HT 2B . La ausencia del efecto hipofágico (reducción del consumo de alimentos) del mCPP en ratones knock out del receptor 5-HT 2C sugiere que este efecto está mediado por la activación del receptor 5-HT 2C . La administración repetida de mCPP a humanos podría resultar en una disminución de la ingesta de alimentos y pérdida de peso. El mCPP se utiliza como una herramienta de investigación prototipo para el descubrimiento de fármacos de agonistas selectivos del receptor 5-HT 2C . [20] [21] [22]

Los receptores 5-HT2C son receptores acoplados a proteína G que están acoplados a la fosfolipasa C (PLC) a través de Gαq , fosfolipasa A2 (PLA2) y posiblemente Gα13. La PLC metaboliza el fosfatidilinositol 4,5-bisfosfato en inositol 1,4,5-trifosfato (IP3). El IP3 regula el flujo celular de Ca 2+ uniéndose a los receptores de IP3, induciendo la liberación de Ca2+. Además, la activación de PLA2 también da como resultado el reclutamiento de una vía RhoA/PLD a través de RhoA , una enzima que regula un amplio espectro de funciones celulares a través de la proteína diana PLD ( fosfolipasa D ). Los receptores 5-HT 2C también pueden estimular la vía de la quinasa regulada por señales extracelulares (ERK) que es activada por neurotrofinas y otras sustancias químicas neuroactivas. La producción de estas sustancias químicas afecta la diferenciación neuronal, la supervivencia, la regeneración y la plasticidad estructural y funcional . Los primeros estudios sobre la vía ERK demostraron que los estabilizadores del estado de ánimo para el tratamiento de la enfermedad maníaco-depresiva estimulaban la vía. Esto condujo a la comprensión de que la estimulación de los receptores 5-HT 2C podría regular los trastornos maníaco-depresivos de una manera similar a los estabilizadores del estado de ánimo. [23] [24] [25] [3]
Los receptores 5-HT 2C se encuentran únicamente en el SNC, donde se pueden encontrar en varias localizaciones. La mayor densidad de expresión del receptor se encuentra en el plexo coroideo . Otras localizaciones cerebrales incluyen el núcleo del tracto solitario , el hipotálamo dorsomedial , el núcleo hipotalámico paraventricular y la amígdala , todos ellos asociados con la regulación de la ingesta de alimentos. Este patrón de distribución puede explicar el efecto que tienen en la función integral en el control de muchas respuestas fisiológicas y conductuales, como la alimentación, la ansiedad, la regulación de la temperatura, la locomoción , el comportamiento sexual y la aparición de convulsiones. [26] [27]

Los receptores 5-HT 2 son receptores acoplados a la proteína G que pueden regular la señalización celular en ausencia de un ligando . Esto se puede explicar mediante un modelo de dos estados (Figura 2) donde el receptor está en equilibrio entre dos estados, un estado activo (R*) y un estado inactivo (R). La actividad efectora basal se define, en parte, por el nivel absoluto de (R*), que aumentará junto con el aumento de la densidad del receptor. Los ligandos que se unen preferentemente al estado R y lo estabilizan se denominan agonistas inversos y reducen la actividad efectora. Los agonistas se unen preferentemente al estado R* y lo estabilizan, aumentando así la actividad efectora. Los antagonistas neutros muestran la misma afinidad por ambas conformaciones y no alteran el equilibrio entre los dos estados, sin embargo ocupan el receptor y pueden bloquear el efecto tanto de los agonistas como de los agonistas inversos. [28] [29]
Los receptores 5-HT 2C y 5-HT 2A tienen una homología de secuencia de aminoácidos similar , con una identidad de secuencia general de aproximadamente el 50 % y un 80 % dentro de los dominios TM, lo que da como resultado un perfil farmacológico similar para los dos receptores. Ambos receptores acoplan las mismas vías de transducción de señales celulares, PLC y PLA2, que conducen a una acumulación de fosfato de inositol y Ca 2+ dentro de la célula postsináptica . [28]
Los receptores 5-HT 2C son los únicos receptores acoplados a proteína G que se conocen que experimentan un proceso postranscripcional de edición de ARN. El gen del receptor 5-HT 2C se encuentra en el cromosoma X , Xq24. Este producto génico experimenta un proceso de edición de ARN que conduce a una disminución de la afinidad de unión del agonista, sin embargo, la unión del antagonista permanece inalterada. Este proceso de edición de ARN genera 14 isoformas únicas del receptor 5-HT 2C que difieren en tres aminoácidos en el segundo bucle intracelular. [28] [30]
La serotonina es un agonista endógeno no selectivo del receptor 5-HT 2C con una constante de unión de K i = 16,0 nM. Cuando la serotonina se une a los receptores, los contactos más importantes se producen en las hélices TM 3, 5 y 6 (Figura 3), mientras que las otras cuatro hélices TM no interactúan directamente con el compuesto serotoninérgico. Cuando se produce la unión de la serotonina, el sitio de amina primaria protonada forma un puente salino con el residuo D134 en TM 3, así como un enlace de hidrógeno con el residuo S138 en TM 3. El anillo indólico aromático forma una fuerte interacción de Van der Waals con los residuos F223 en TM 5 y F328 en TM 6. El anillo cae firmemente en el bolsillo del receptor, apilado entre dos fenilalaninas . La amina del grupo indol forma un enlace de hidrógeno con el residuo S219 en TM 5 y el sustituyente hidróxido del indol forma enlaces de hidrógeno tanto con el residuo S131 en TM 3 como con I332 en TM 6. También hay una fuerte interacción de Van der Waals entre el indol y el I332 en TM 6. [31]

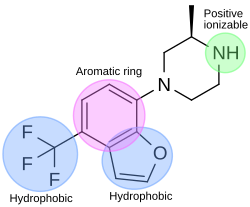
En el proceso de descubrimiento de fármacos agonistas de 5-HT 2C , se ha utilizado un módulo farmacóforo para descubrir nuevos ligandos del receptor 5-HT 2C . El farmacóforo tiene cuatro características: un anillo aromático, dos características hidrofóbicas y una característica ionizable positiva. La Figura 4 muestra un ejemplo de un compuesto que se ajusta perfectamente al farmacóforo agonista. El átomo de nitrógeno de la piperazina se ajusta a la característica ionizable positiva, la parte de benzofurano se ajusta al anillo aromático y a una característica hidrofóbica, y la parte de trifluorometano se ajusta a otra característica hidrofóbica del farmacóforo. [32]
En una pantalla virtual para nuevos agonistas, se determinó una relación estructura-actividad a partir de los compuestos más potentes ('hits') identificados. [ aclaración necesaria ] Estos hits contenían un núcleo de pirazolo[3,4-d]pirimidina (mostrado en la figura 5), que es importante para la potencia hacia los receptores 5-HT 2C . Los compuestos con máxima potencia presentaban dos sustituyentes unidos a la estructura del núcleo. El primer sustituyente es un anillo de piperazina, que contiene un pequeño grupo hidrófobo; el segundo sustituyente es una parte fenila que contiene una cadena lateral que contiene halógeno y/o oxígeno (grupos electronegativos), véanse los derivados 1 y 2 en la figura 5. La adición de grupos aromáticos al anillo de piperazina reduce la potencia (derivado 4 en la figura 5) y la ausencia del anillo de piperazina o la sustitución con otros grupos alifáticos o cíclicos también reduce la potencia (derivados 5 y 6 en la figura 5). [32]

Se han evaluado una serie de derivados de 3-benzazepina, como la lorcaserina (Figura 6), por su potencia y selectividad para los receptores 5-HT 2C . La lorcaserina es un agonista muy potente, pero su potencia depende de la presencia de un sustituyente de cloro en la posición 8. [7] [33] [34]
Los compuestos que contienen arilpiperazina, como el mCPP (Figura 7), muestran una buena potencia hacia los receptores 5-HT 2C , pero no tienen suficiente selectividad para los receptores 5-HT 2C en comparación con los otros dos subtipos de receptores. Se han examinado muchos derivados en un intento de aumentar la selectividad. Los derivados que carecen del núcleo de arilpiperazina, como los análogos de cloro 4-aril-1,2,3,6-tetrahidropiridinio, son más favorables para la potencia y la selectividad en comparación con los otros dos receptores (Figura 7). [35]
En 2016 se publicó el descubrimiento de nuevos agonistas del receptor 5-HT 2C sesgados por la proteína G. [36]
La obesidad es un problema de salud epidémico mundial y ha recibido considerable atención como un importante peligro público. La obesidad es una enfermedad patológica crónica y costosa que se caracteriza por la acumulación anormal o excesiva de grasa en el cuerpo. [37]
Los estudios indican que la activación del receptor 5-HT 2C regulará el apetito y el consumo de alimentos, probablemente promoviendo la saciedad a través de la supresión del apetito por la activación del 5-HT 2C . En consecuencia, se están desarrollando agentes selectivos con alta afinidad por este receptor sobre el 5-HT 2B y el 5-HT2 2A para el tratamiento de la obesidad. [38] [6]
Pumosetrag fue el ejemplo establecido por Mitsubishi Chemical Corporation .
La lorcaserina es el único agente que ha completado los ensayos clínicos de fase III y ha obtenido la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Sin embargo, se retiró del mercado en febrero de 2020 debido a un mayor riesgo de malignidad en un ensayo aleatorizado de lorcaserina. [39] Los agentes aprobados previamente se retiraron posteriormente del mercado estadounidense. [6]
La lorcaserina es un agonista completo de los receptores 5-HT 2C y 5-HT 2B y un agonista parcial de los receptores 5-HT 2A (75% de la respuesta máxima provocada por la serotonina). [7] La lorcaserina es un agonista potente y selectivo de 5-HT 2C con una rápida absorción oral que muestra una disminución dependiente de la dosis en la ingesta de alimentos y el peso corporal. La lorcaserina afecta el peso corporal al producir un balance energético negativo a través de la ingesta reducida de alimentos (ingesta de energía) sin alteraciones en el gasto energético y la oxidación del sustrato . [11] La lorcaserina tiene una alta afinidad por los receptores 5-HT 2C , con una selectividad 18 veces mayor que la de los receptores 5-HT 2A y 104 veces mayor que la de los receptores 5-HT 2B . [7] La concentración sanguínea prevista para estimular los receptores 2A y 2B es aproximadamente 1400 veces mayor para 2B y 250 veces mayor para 2A, por encima de la concentración sanguínea que se requiere para estimular los receptores 2C. Esta selectividad funcional es fundamental para prevenir posibles efectos secundarios y sugiere que el riesgo teórico de valvulopatía cardíaca es muy bajo. Los ensayos clínicos han apoyado esta teoría ya que no han revelado ningún efecto secundario sobre las válvulas cardíacas o la presión arterial pulmonar como los antiguos fármacos contra la obesidad. La lorcaserina es bien tolerada en general, pero los efectos adversos más frecuentes son dolor de cabeza, náuseas y mareos. [7] [11]
La serotonina desempeña un papel importante en numerosas condiciones fisiológicas. Los antagonistas del receptor 5-HT 2 se conocen desde hace mucho tiempo, pero recientemente los agonistas del receptor 5-HT 2 se están convirtiendo en agentes prometedores en el desarrollo de nuevos fármacos antipsicóticos . Históricamente, la mayoría de la investigación farmacológica sobre fármacos antipsicóticos se ha concentrado en el subtipo de receptor 5-HT 2A . Sin embargo, estudios recientes muestran que la actividad agonista en los receptores 5-HT 2A puede causar alucinaciones. La comparación de los ISRS y los agonistas del receptor 5-HT 2C mostró que los agonistas disminuyeron el tiempo de inmovilidad y aumentaron el tiempo de natación en la FST ( prueba de natación forzada ) en ratas de una manera comparable a los ISRS. En la década de 1990, los receptores 5-HT 2C han recibido más atención ya que muchos estudios han demostrado que los agonistas selectivos del receptor 5-HT 2C pueden ser más adecuados en el tratamiento de indicaciones psicóticas. [40] [41]
Se puede esperar que un agonista 5-HT 2C reduzca los síntomas positivos de la esquizofrenia al reducir la liberación de dopamina en la vía dopaminérgica mesolímbica . La vabicaserina (SCA-136) es un agonista 5-HT 2C que ha demostrado ser prometedor en pruebas preliminares para el tratamiento de la esquizofrenia. [42]
La vabicaserina tiene una alta afinidad por los receptores 5-HT 2C y una baja afinidad por los receptores 5-HT 2B y 5-HT 2A . La vabicaserina es un agonista completo con una selectividad aproximadamente 4 veces mayor por 5-HT 2C que por estos receptores relacionados, en términos de afinidad de unión. La vabicacserina es un agonista completo en la estimulación del receptor 5-HT 2C ; se descubrió cuando se estaba investigando una clase de diazepinas fusionadas con tetrahidroquinolina como posibles agonistas potentes del receptor 5-HT 2C . [43]
A partir de 2012, la vabicaserina se encuentra en ensayos clínicos para el tratamiento de la esquizofrenia. La administración a largo plazo de vabicaserina redujo significativamente el número de neuronas dopaminérgicas mesocorticolímbicas espontáneamente activas sin afectar a las neuronas dopaminérgicas nigroestriatales , en consonancia con los efectos de los agentes antipsicóticos atípicos . El resultado de los estudios clínicos de vabicaserina puede revelar si los receptores 5-HT 2C pueden ser posibles objetivos para el tratamiento de la esquizofrenia. [44]
El aripiprazol también es un agonista parcial leve del receptor 5HT 2C .
Se ha informado que la activación del subtipo del receptor 5-HT 2C media numerosos efectos, como la erección del pene. [45] [46] Según múltiples estudios, los resultados muestran que varios agonistas del receptor 5-HT 2C , incluidos mCPP y YM348, inducen erecciones del pene en ratas, [47] pero mCPP parece imitar tanto la vasodilatación como la vasoconstricción . La acción vasodilatadora está mediada por los receptores 5-HT 1D , mientras que el efecto vasoconstricción implica la activación del receptor 5-HT 2. [48] YM-348 es un agonista 5-HT 2C altamente selectivo y los resultados muestran que YM348 puede inducir erecciones del pene e hipolocomoción (inducida a una dosis alta) en ratas, al igual que otros agonistas del receptor 5-HT 2C . Estos efectos fueron completamente inhibidos por un antagonista selectivo del receptor 5-HT 2C , SB-242,084 . Por lo tanto, los resultados sugieren que YM348 es un agonista del receptor 5-HT 2C potente y activo por vía oral . [49] [50]
La serotonina desempeña un papel fundamental en los mecanismos implicados en la micción y la continencia. Se han sintetizado numerosos compuestos potentes con alta selectividad por los receptores 5-HT 2C y son candidatos prometedores para un mayor desarrollo en el tratamiento de la incontinencia urinaria de esfuerzo (IUE). [50]
Desde el descubrimiento de los receptores 5-HT 2C se han desarrollado muchos agentes exógenos . Hasta ahora, se ha estudiado en ensayos clínicos un pequeño número de agonistas con suficiente selectividad para los receptores 5-HT 2C sobre los otros subtipos. Una variedad de otros agonistas del receptor 5-HT 2C permanecen en desarrollo preclínico , incluyendo Ro60-0175 , WAY-163,909 y el agonista inverso SB-243,213 . La evidencia apoya un potencial terapéutico de la modulación del receptor 5-HT 2C en el tratamiento de una variedad de condiciones patológicas, incluyendo esquizofrenia, obesidad, incontinencia urinaria y disfunción sexual. [42]