El hinokitiol ( β-tuyaplicina ) es un monoterpenoide natural que se encuentra en la madera de los árboles de la familia Cupressaceae . Es un derivado de la tropolona y una de las tuyaplicinas . [3] El hinokitiol se utiliza en productos para el cuidado bucal y de la piel, [4] [5] y es un aditivo alimentario utilizado en Japón . [6]
El hinokitiol fue descubierto por el químico japonés Tetsuo Nozoe en 1936. Fue aislado del componente de aceite esencial del duramen del hinoki taiwanés , del cual el compuesto finalmente adoptó su nombre. [7] El hinokitiol es el primer compuesto aromático no bencenoide identificado. [8] El compuesto tiene una estructura molecular heptagonal y fue sintetizado por primera vez por Ralph Raphael en 1951. [9] Debido a su actividad quelante de hierro, el hinokitiol ha sido llamado una "molécula de Iron Man" en los medios científicos, lo cual es irónico porque Tetsuo se traduce al inglés como "Iron Man". [10] El hinoki taiwanés es originario de los países del este de Asia , particularmente de Japón y Taiwán . [11] El hinokitiol también se ha encontrado en otros árboles de la familia Cupressaceae , incluido Thuja plicata Donn ex D. Don , que es común en el noroeste del Pacífico .
Las maderas ricas en hinokitiol fueron utilizadas por la gente del antiguo Japón para crear edificios de larga duración, como el Konjiki-dō , un tesoro nacional japonés, uno de los edificios del complejo Chūson-ji , un templo en la prefectura de Iwate . Lo protegió de daños por parte de insectos , hongos que pudren la madera y moho durante un largo tiempo de aproximadamente 840 años. Además, hay algunos templos budistas antiguos y santuarios sintoístas famosos que utilizan árboles, que más tarde se supo que contenían hinokitiol. [12] A partir de la década de 2000, las propiedades biológicas del hinokitiol se convirtieron en un tema de interés para la investigación, centrándose en sus propiedades biológicas. [10] Y la resistencia de los cipreses a la descomposición de la madera fue la principal razón que impulsó a estudiar su contenido químico y encontrar las sustancias responsables de esas propiedades. [13]
Se ha encontrado hinokitiol en el duramen de los árboles de coníferas de la familia Cupressaceae , incluidos Chamaecyparis obtusa (ciprés hinoki), Thuja plicata (cedro rojo occidental), Thujopsis dolabrata var. hondai (Hinoki asunaro), Juniperus cedrus (enebro de Canarias), Cedrus atlantica (cedro del Atlas), Cupressus lusitanica (cedro blanco mexicano), Chamaecyparis lawsoniana (cedro de Port Orford), Chamaecyparis taiwanensis (ciprés de Taiwán), Chamaecyparis thyoides ( cedro blanco del Atlántico), Cupressus arizonica (ciprés de Arizona), Cupressus macnabian a (ciprés de MacNab), Cupressus macrocarpa (ciprés de Monterrey), Juniperus chinensis (enebro chino), Juniperus communis (enebro común), Juniperus californica (enebro de California), Juniperus occidentalis (enebro occidental), Juniperus oxycedrus (Cade), Juniperus sabina (enebro de Savin), Calocedrus decurrens (cedro de incienso de California), Calocedrus formosana (cedro de incienso de Taiwán), Platycladus orientalis (tuya china), Thuja occidentalis (cedro blanco del norte), Thuja standishii (tuya japonesa), Tetraclinis articulata (Sandarac). [14] [15] [16] [17]
Su concentración en los árboles es de 0,1-0,2% en Chamaecyparis taiwanensis (2 mg de hinokitiol por 1 g de aserrín seco), 0,04% en Juniperus cedrus y Thujopsis dolabrata var. hondai (0,4 mg de hinokitiol por 1 g de aserrín seco), y 0,02% en Chamaecyparis obtusa (0,2 mg de hinokitiol por 1 g de aserrín seco). [7] [18]
Existen tres tuyaplicinas presentes en la naturaleza : α-tuyaplicina, β-tuyaplicina (hinokitiol) y γ-tuyaplicina. El hinokitiol es el isómero más común y parece ser el único que ejerce todas las actividades biológicas atribuidas a las tuyaplicinas. [19] [20]
Existen diferentes vías para sintetizar tuyaplicinas. El hinokitiol, como otras tuyaplicinas, se puede sintetizar por cicloadición de isopropil ciclopentadieno y dicloroceteno, cicloadición 1,3-dipolar de 5-isopropil-1-metil-3-oxidopiridinio, expansión de anillo de 2-isopropilciclohexanona, hidroxilación regiocontrolada de cicloaductos de oxialilo (4+3) , regioselectivamente a partir de ( R )-(+)- limoneno y a partir del complejo troponeirontricarbonilo. [21] [22] El hinokitiol también se puede aislar a través de cultivos de suspensión de células vegetales , [23] [24] o se puede extraer fácilmente de la madera con disolventes químicos y ultrasonicación . [25]
(1) Síntesis de hinokitiol a partir del complejo troponeirontricarbonilo:
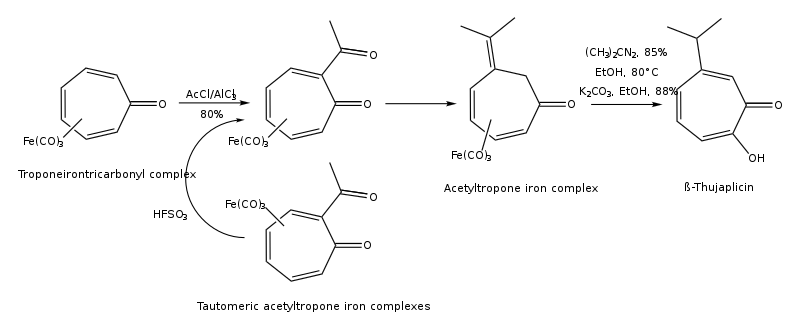
(2) Síntesis de hinokitiol por alquilación electrorreductora de cicloheptatrienos sustituidos:
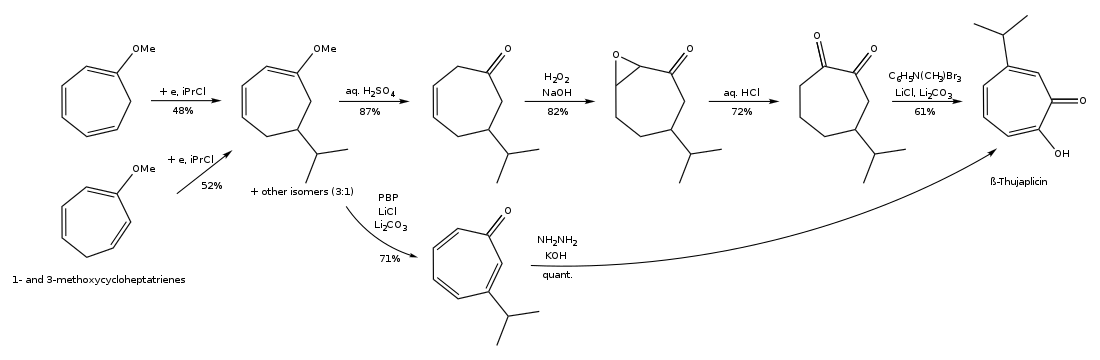
(3) Síntesis de hinokitiol mediante expansión del anillo de 2-isopropilciclohexanona:
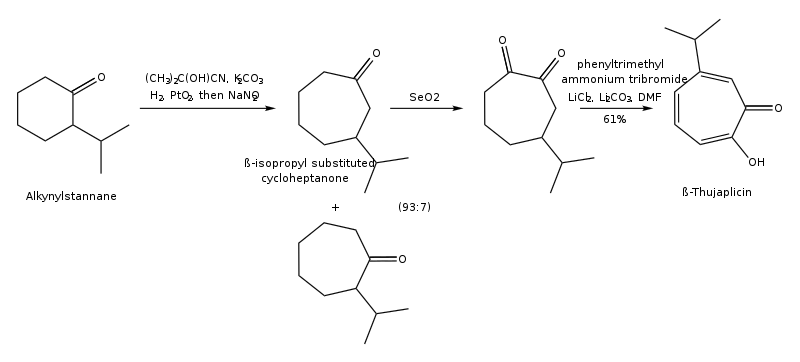
(4) Síntesis de hinokitiol a través de la ciclización del catión oxialilo [4+3] (síntesis de Noyori):

El hinokitiol es un derivado de tropolona que contiene un anillo de carbono insaturado de siete miembros. Es un monoterpenoide , ciclohepta-2,4,6-trien-1-ona sustituido por un grupo hidroxi en la posición 2 y un grupo isopropilo en la posición 4. [26] [27] [28] Es un enol y una cetona cíclica . Deriva de un hidruro de un ciclohepta-1,3,5-trieno . Las tuyaplicinas son solubles en disolventes orgánicos y tampones acuosos. [2] El hinokitiol proporciona acetona en la oxidación vigorosa y da el diol monocíclico saturado en la hidrogenación catalítica. [7] Es estable a los álcalis y ácidos, formando sales o permaneciendo inalterado, pero no se convierte en derivados de catecol. El hinokitiol, como otras tuyaplicinas y tropolonas, se une reversiblemente a los iones metálicos. Forma sales complejas con iones metálicos.
El hinokitiol, como otras tropolonas , se une reversiblemente a iones metálicos (es decir, Zn 2+ , Fe 2+ , Cu 2+ , Co 2+ , Mn 2+ , Ag 2+ ) y forma sales complejas . Se considera un metalóforo de amplio espectro y un eficaz agente quelante de hierro . [17] El complejo de hierro con hinokitiol con la fórmula (C 10 H 11 O 2 ) 3 Fe se llama hinokitina. El aceite de hinoki es rico en hinokitina, que tiene una apariencia de cristales de color rojo oscuro. [7] Los complejos hechos de hierro y tropolonas muestran una alta estabilidad termodinámica y han demostrado tener una constante de unión más fuerte que el complejo transferrina-hierro. [29] Se cree que la actividad de unión de metales puede ser el principal mecanismo de acción subyacente a la mayor parte de sus actividades biológicas, especialmente la unión de iones de hierro, zinc y cobre. [20] Al unirse a diferentes iones metálicos y actuar como ionóforo , acelera la captación intracelular de dichos iones y aumenta sus niveles intracelulares, influyendo así en diferentes actividades biológicas. Se ha demostrado que puede producirse un efecto sinérgico en algunas actividades y entornos biológicos cuando los ionóforos se combinan con los iones a los que se unen. [30] Como ionóforo, su molécula tiene un centro hidrófilo y una parte hidrófoba. La parte hidrófoba interactúa con las membranas biológicas. El centro hidrófilo se une a los iones metálicos y forma complejos ionóforo-ion.
El hinokitiol y otras tuyaplicinas se han investigado principalmente en estudios in vitro y en modelos animales por sus posibles propiedades biológicas, como efectos antimicrobianos, antifúngicos, antivirales, antiproliferativos, antiinflamatorios y antiplasmodiales. [10] [17] [20] Sin embargo, no existe evidencia de estudios clínicos que respalde estos hallazgos. También se ha demostrado que tiene efectos insecticidas, pesticidas y antipardeamiento. Se cree que la gran mayoría de estas propiedades se deben a la actividad de unión de iones metálicos. El hinokitiol pareció ejercer todas las actividades in vitro atribuidas a las tuyaplicinas. [20]
Se ha demostrado que el hinokitiol posee efectos inhibidores sobre Chlamydia trachomatis y puede ser clínicamente útil como fármaco tópico. [31] [10]
Se ha probado la seguridad del hinokitiol en ratas y no se encontró ningún efecto cancerígeno en ellas. [32] En 2006, el hinokitiol fue clasificado en la lista de sustancias nacionales (DSL) de Canadá como no persistente, no bioacumulable y no tóxico para los organismos acuáticos. [33]
El hinokitiol se utiliza en una variedad de productos de consumo destinados al cuidado de la piel, como jabones , lociones para la piel , limpiadores de párpados , champús y tónicos para el cabello ; [4] [34] [35] para el cuidado bucal, como pastas de dientes y aerosoles para el aliento . [4] [5] [36]
En abril de 2020, Advance Nanotek, un productor australiano de óxido de zinc, presentó una solicitud de patente conjunta con AstiVita Limited para una composición antiviral que incluía productos para el cuidado bucal. [37]
Se ha descubierto que el hinokitiol tiene actividades insecticidas y pesticidas contra termitas que dañan los cultivos ( Reticulitermes speratus , Coptotermes formosanus ) y escarabajos ( Lasioderma serricorne , Callosobruchus chinensis ). [15] [38] [17] También se ha demostrado que actúa contra ciertos ácaros ( Dermatophagoides farinae , Tyrophagus putrescentiae ) y larvas de mosquitos ( Aedes aegypti , Culex pipiens ). El hinokitiol se complementa en repelentes comerciales de garrapatas e insectos . [19]
En estudios experimentales, se ha demostrado que el hinokitiol actúa contra Botrytis cinerea , un hongo necrotrófico que causa moho gris en muchas especies de plantas y que se sabe que daña los cultivos hortícolas . Por lo tanto, se ha sugerido su uso para el encerado poscosecha para prevenir la descomposición poscosecha . [17] [39] El hinokitiol es un aditivo alimentario registrado en Japón. [6] El hinokitiol parece suprimir el pardeamiento de los alimentos mediante la inhibición de las enzimas de pardeamiento , en particular la tirosinasa y otras polifenol oxidasas mediante la quelación de iones de cobre . [17] Este efecto se ha demostrado en diferentes verduras, frutas, hongos, flores, plantas, otros productos agrícolas y mariscos. [40] Debido a estos últimos efectos, el hinokitiol se utiliza en el envasado de alimentos como agente extensor de la vida útil . [41]
El hinokitiol es uno de los compuestos químicos aislados de los árboles, conocidos como extractivos , responsables de la durabilidad natural de ciertos árboles. El hinokitiol se encuentra en el duramen de árboles naturalmente durables que pertenecen a la familia Cupressaceae . [13] [42] Estos compuestos le dan a la madera una resistencia natural a la descomposición y a los ataques de insectos debido a sus actividades fungicidas, insecticidas y pesticidas. Por lo tanto, se sugiere que el hinokitiol, como algunos otros extractivos naturales, se use como conservante de la madera para el tratamiento de la madera . [18]
Los investigadores que analizaron una biblioteca de pequeñas biomoléculas en busca de señales de transporte de hierro descubrieron que el hinokitiol restablecía la funcionalidad celular. Trabajos posteriores del equipo sugirieron un mecanismo por el cual el hinokitiol restablece o reduce el hierro celular. [43]
Diferentes estudios in vitro han investigado los efectos del hinokitiol en varias líneas de células tumorales .