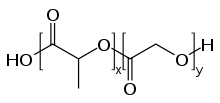
El PLGA , PLG o ácido poli(láctico- co -glicólico) ( CAS : 26780-50-7) es un copolímero que se utiliza en una serie de dispositivos terapéuticos aprobados por la Administración de Alimentos y Medicamentos (FDA), debido a su biodegradabilidad y biocompatibilidad . [1] El PLGA se sintetiza mediante copolimerización por apertura de anillo de dos monómeros diferentes , los dímeros cíclicos (1,4-dioxano-2,5-dionas) de ácido glicólico y ácido láctico . Los polímeros se pueden sintetizar como copolímeros aleatorios o en bloque, lo que imparte propiedades poliméricas adicionales. Los catalizadores comunes utilizados en la preparación de este polímero incluyen 2-etilhexanoato de estaño (II) , alcóxidos de estaño (II) o isopropóxido de aluminio . Durante la polimerización, las unidades monoméricas sucesivas (de ácido glicólico o láctico) se unen entre sí en el PLGA mediante enlaces éster , lo que produce un poliéster alifático lineal como producto. [2]
Dependiendo de la relación de lactida a glicolida utilizada para la polimerización, se pueden obtener diferentes formas de PLGA: estas generalmente se identifican con respecto a la relación molar de los monómeros utilizados (por ejemplo, PLGA 75:25 identifica un copolímero cuya composición es 75% de ácido láctico y 25% de ácido glicólico). La cristalinidad de los PLGA variará de completamente amorfo a completamente cristalino dependiendo de la estructura del bloque y la relación molar. Los PLGA generalmente muestran una temperatura de transición vítrea en el rango de 40-60 °C. El PLGA se puede disolver con una amplia gama de solventes , dependiendo de la composición. Los polímeros con mayor contenido de lactida se pueden disolver utilizando solventes clorados , mientras que los materiales con mayor contenido de glicolida requerirán el uso de solventes fluorados como HFIP .
El PLGA se degrada por hidrólisis de sus enlaces éster en presencia de agua . Se ha demostrado que el tiempo necesario para la degradación del PLGA está relacionado con la proporción de monómeros utilizados en la producción: cuanto mayor sea el contenido de unidades de glicólido, menor será el tiempo necesario para la degradación en comparación con los materiales predominantemente láctidos. Una excepción a esta regla es el copolímero con una proporción de monómeros de 50:50 que exhibe la degradación más rápida (alrededor de dos meses). Además, los polímeros que están protegidos con ésteres (a diferencia del ácido carboxílico libre ) demuestran vidas medias de degradación más largas. [3] Esta flexibilidad en la degradación lo ha hecho conveniente para la fabricación de muchos dispositivos médicos , como injertos , suturas , implantes , dispositivos protésicos , películas de sellado quirúrgico, micro y nanopartículas . [4]
El PLGA sufre hidrólisis en el cuerpo para producir los monómeros originales: ácido láctico y ácido glicólico. Estos dos monómeros, en condiciones fisiológicas normales, son subproductos de varias vías metabólicas en el cuerpo. El ácido láctico se metaboliza en el ciclo del ácido tricarboxílico y se elimina a través del dióxido de carbono y el agua . El ácido glicólico se metaboliza de la misma manera y también se excreta a través del riñón. [5] El cuerpo también puede metabolizar los dos monómeros, lo que en el caso del ácido glicólico produce pequeñas cantidades del tóxico ácido oxálico , aunque las cantidades producidas a partir de aplicaciones típicas son minúsculas y existe una toxicidad sistémica mínima asociada con el uso de PLGA para aplicaciones de biomateriales . Sin embargo, se ha informado de que la degradación ácida del PLGA reduce el pH local lo suficiente como para crear un entorno autocatalítico . [6] Se ha demostrado que el pH dentro de una microesfera puede llegar a ser tan ácido como pH 1,5. [7]
En general, se considera que el PLGA es bastante biocompatible. Su alta biocompatibilidad resulta de su composición, debida a la fermentación del ácido láctico y glicólico a partir de azúcares, lo que lo hace ecológico y menos reactivo en el cuerpo. [8] El PLGA también se degrada en productos no tóxicos y no reactivos, lo que lo hace bastante útil para diversas aplicaciones médicas y farmacéuticas.
La biocompatibilidad del PLGA se ha probado tanto in vivo como in vitro. [9] La biocompatibilidad de este polímero está determinada generalmente por los productos en los que se degrada, así como por la velocidad de degradación en productos de degradación. La forma en que se degrada el PLGA es por medio de una enzima conocida como esterasa , que forma ácido láctico y ácido glicólico. Estos ácidos luego pasan por el ciclo de Krebs para degradarse como dióxido de carbono (CO 2 ) y agua ( H 2 O ). [10] Estos subproductos luego se eliminan del cuerpo a través de la respiración celular y del proceso digestivo.
Si bien los subproductos generalmente no se acumulan en el cuerpo, hay casos en los que estos subproductos (ácido láctico y glicólico) pueden ser peligrosos para el cuerpo cuando se acumulan en altas concentraciones locales. [11] También puede haber pequeños trozos de los polímeros a medida que el polímero se degrada, lo que provoca una respuesta inmunitaria por parte de los macrófagos . Estos efectos adversos se pueden reducir utilizando concentraciones más bajas del polímero, de modo que se libere de forma natural en todo el cuerpo.
Otro aspecto que se debe tener en cuenta en relación con la biocompatibilidad del PLGA es el lugar en el que se implanta o coloca el polímero en el cuerpo. Existen diferentes respuestas inmunitarias que el cuerpo puede tener según el lugar en el que se coloque el polímero. Por ejemplo, en los sistemas de administración de fármacos (DDS), los implantes de PLGA y PLA con una gran superficie y un bajo volumen de inyección pueden aumentar las posibilidades de que se produzca una respuesta inmunitaria a medida que los polímeros se degradan en el cuerpo.
La biodegradación del PLGA lo hace útil para muchas prácticas médicas. El PLGA sufre una degradación en masa, que es cuando un catalizador como el agua se inserta en toda la matriz del polímero. [12] Se puede obtener una proporción de PLGA de 75:25 de lactida a glicólido en forma de microesferas que se degradan mediante erosión en masa. [12] Esto permite que la degradación en todo el polímero se produzca de manera uniforme.
Se desarrolló otra forma inyectable de PLGA para tener sistemas de erosión. Esta forma se puede utilizar en Lupron Depot . Para lograr esto, el PLGA se mezcla con un solvente orgánico miscible en agua aprobado por la Administración de Alimentos y Medicamentos (FDA). Una vez que el PLGA se mezcla en el solvente con el fármaco de elección para crear una solución o suspensión homogénea. Cuando se inyecta esta mezcla, el PLGA se solidifica debido a la insolubilidad en agua y es reemplazado por el agua. Lentamente, el fármaco se libera desde la solución. Un problema que puede ocurrir es que durante la inyección inicial, el fármaco puede liberarse en una ráfaga rápida en lugar de gradualmente. [12]
Algunos ejemplos específicos del uso del PLGA incluyen: