El ácido fluorhídrico es una solución de fluoruro de hidrógeno (HF) en agua . Las soluciones de HF son incoloras, ácidas y altamente corrosivas . Una concentración común es del 49% (48-52%), pero también hay soluciones más fuertes (por ejemplo, 70%) y el HF puro tiene un punto de ebullición cercano a la temperatura ambiente. Se utiliza para fabricar la mayoría de los compuestos que contienen flúor; Los ejemplos incluyen el medicamento antidepresivo farmacéutico comúnmente utilizado fluoxetina (Prozac) y el material PTFE (Teflón). A partir de él se produce flúor elemental . Se utiliza comúnmente para grabar obleas de vidrio y silicio.
El uso principal del ácido fluorhídrico es en la química organofluorada . Muchos compuestos organofluorados se preparan utilizando HF como fuente de flúor, incluido el teflón , fluoropolímeros , fluorocarbonos y refrigerantes como el freón . Muchos productos farmacéuticos contienen flúor. [4]
La mayoría de los compuestos de fluoruro inorgánicos de alto volumen se preparan a partir de ácido fluorhídrico. Los más importantes son Na 3 AlF 6 , criolita y AlF 3 , trifluoruro de aluminio . Una mezcla fundida de estos sólidos sirve como disolvente a alta temperatura para la producción de aluminio metálico . Otros fluoruros inorgánicos preparados a partir de ácido fluorhídrico incluyen fluoruro de sodio y hexafluoruro de uranio . [4]
_0468.jpg/440px-Wet_etching_tanks_at_LAAS_(6_inches)_0468.jpg)
Se utiliza en la industria de los semiconductores como componente principal del grabado de Wright y del grabado con óxido tamponado , que se utilizan para limpiar obleas de silicio . De manera similar, también se utiliza para grabar vidrio mediante tratamiento con dióxido de silicio para formar fluoruros de silicio gaseosos o solubles en agua. También se puede utilizar para pulir y escarchar vidrio. [5]
También se usa comúnmente un gel de ácido fluorhídrico del 5% al 9% para grabar todas las restauraciones dentales de cerámica para mejorar la unión. [6] Por razones similares, el ácido fluorhídrico diluido es un componente del quitamanchas de óxido doméstico, en lavados de automóviles en compuestos "limpiadores de ruedas", en inhibidores de óxido de cerámica y telas y en quitamanchas de agua. [5] [7] Debido a su capacidad para disolver óxidos de hierro y contaminantes a base de sílice, el ácido fluorhídrico se utiliza en la puesta en marcha previa de calderas que producen vapor a alta presión. El ácido fluorhídrico también es útil para disolver muestras de rocas (generalmente en polvo) antes del análisis. De manera similar, este ácido se utiliza en maceraciones ácidas para extraer fósiles orgánicos de rocas de silicato. La roca fosilífera se puede sumergir directamente en el ácido, o se puede aplicar una película de nitrato de celulosa (disuelta en acetato de amilo ), que se adhiere al componente orgánico y permite que la roca se disuelva a su alrededor. [8]
En un proceso estándar de refinería de petróleo conocido como alquilación , el isobutano se alquila con alquenos de bajo peso molecular (principalmente una mezcla de propileno y butileno ) en presencia de un catalizador ácido derivado del ácido fluorhídrico. El catalizador protona los alquenos (propileno, butileno) para producir carbocationes reactivos , que alquilan el isobutano. La reacción se lleva a cabo a temperaturas suaves (0 y 30 °C) en una reacción de dos fases.
El ácido fluorhídrico fue preparado por primera vez en 1771 por Carl Wilhelm Scheele . [9] Actualmente se produce principalmente mediante el tratamiento del mineral fluorita , CaF 2 , con ácido sulfúrico concentrado a aproximadamente 265 °C.
El ácido también es un subproducto de la producción de ácido fosfórico a partir de apatita y fluorapatita . La digestión del mineral con ácido sulfúrico a temperaturas elevadas libera una mezcla de gases, incluido fluoruro de hidrógeno, que puede recuperarse. [4]
Debido a su alta reactividad con el vidrio, el ácido fluorhídrico se almacena en recipientes de plástico fluorado (a menudo PTFE ). [4] [5]
En solución acuosa diluida, el fluoruro de hidrógeno se comporta como un ácido débil. [10] Se ha utilizado espectroscopía infrarroja para mostrar que, en solución, la disociación va acompañada de la formación del par iónico H 3 O + ·F − . [11] [12]
Este par iónico se ha caracterizado en estado cristalino a muy baja temperatura. [13] Se ha caracterizado una mayor asociación tanto en solución como en estado sólido. [ cita necesaria ]
Se supone que la polimerización se produce a medida que aumenta la concentración. Esta suposición está respaldada por el aislamiento de una sal de un anión tetramérico H
3F−
4[14] y por cristalografía de rayos X a baja temperatura. [13] No todas las especies que están presentes en soluciones acuosas concentradas de fluoruro de hidrógeno han sido caracterizadas; además de HF−
2que se conoce [11] la formación de otras especies poliméricas, H
norte −1F−
norte, es muy probable.
La función de acidez de Hammett , H 0 , para 100 % HF se informó por primera vez como -10,2, [15] mientras que compilaciones posteriores muestran -11, comparable a valores cercanos a -12 para el ácido sulfúrico puro . [16] [17]
A diferencia de otros ácidos halohídricos , como el ácido clorhídrico , el fluoruro de hidrógeno es sólo un ácido débil en solución acuosa diluida. [18] Esto se debe en parte a la fuerza del enlace hidrógeno-flúor, pero también a otros factores como la tendencia del HF, H
2O y F−
aniones para formar grupos. [19] En altas concentraciones, las moléculas de HF se someten a homoasociación para formar iones poliatómicos (como bifluoruro , HF−
2) y protones , aumentando así considerablemente la acidez. [20] Esto conduce a la protonación de ácidos muy fuertes como el ácido clorhídrico, sulfúrico o nítrico cuando se utilizan soluciones concentradas de ácido fluorhídrico. [21] Aunque el ácido fluorhídrico se considera un ácido débil, es muy corrosivo, atacando incluso al vidrio cuando se hidrata. [20]
Las soluciones diluidas son débilmente ácidas con una constante de ionización ácida K a =6,6 × 10 −4 (o p K a = 3,18 ), [10] en contraste con las soluciones correspondientes de los otros haluros de hidrógeno, que son ácidos fuertes ( p K a < 0 ). Sin embargo, las soluciones concentradas de fluoruro de hidrógeno son mucho más ácidas de lo que implica este valor, como lo demuestran las mediciones de la función de acidez H 0 de Hammett (o "pH efectivo"). Durante la autoionización de HF 100 % líquido, el H 0 se midió primero como −10,2 [15] y luego se compiló como −11, comparable a valores cercanos a −12 para el ácido sulfúrico . [16] [17]
En términos termodinámicos, las soluciones de HF son muy no ideales , ya que la actividad del HF aumenta mucho más rápidamente que su concentración. La débil acidez en la solución diluida a veces se atribuye a la alta fuerza del enlace H-F , que se combina con la alta entalpía de disolución del HF para compensar la entalpía más negativa de hidratación del ion fluoruro. [22] Paul Giguère y Sylvia Turrell [11] [12] han demostrado mediante espectroscopía infrarroja que la especie de soluto predominante en una solución diluida es el par iónico unido por enlaces de hidrógeno H 3 O + ·F − . [23]
Al aumentar la concentración de HF, también aumenta la concentración del ion difluoruro de hidrógeno . [11] La reacción
es un ejemplo de homoconjugación .
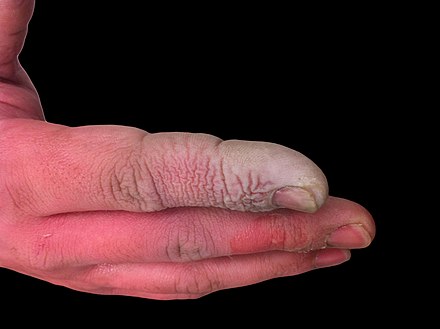
Además de ser un líquido altamente corrosivo , el ácido fluorhídrico también es un poderoso veneno de contacto . Debido a la capacidad del ácido fluorhídrico para penetrar los tejidos, el envenenamiento puede ocurrir fácilmente mediante la exposición de la piel o los ojos, o cuando se inhala o ingiere. Los síntomas de la exposición al ácido fluorhídrico pueden no ser evidentes de inmediato, lo que puede proporcionar una falsa tranquilidad a las víctimas y hacer que retrasen el tratamiento médico. [24] A pesar de tener un olor irritante, el HF puede alcanzar niveles peligrosos sin un olor evidente. [5] La IC interfiere con la función nerviosa, lo que significa que las quemaduras pueden no ser dolorosas inicialmente. Las exposiciones accidentales pueden pasar desapercibidas, retrasando el tratamiento y aumentando el alcance y la gravedad de la lesión. [24] Los síntomas de la exposición al HF incluyen irritación de los ojos, piel, nariz y garganta, quemaduras en los ojos y la piel, rinitis , bronquitis , edema pulmonar (acumulación de líquido en los pulmones) y daño óseo [25] debido a la fuerte interacción del HF. con calcio en los huesos. [26]
Las quemaduras con fluorhídrico se tratan con un gel de gluconato de calcio .
En los episodios " Cat's in the Bag... " y " Box Cutter " de la serie de televisión de drama criminal Breaking Bad , Walter White y Jesse Pinkman utilizan ácido fluorhídrico para desincorporar químicamente los cuerpos de los gánsteres. [27] [28]
la molécula de HF puede causar daño tisular profundo, incluida la destrucción del hueso. ... cuando los iones fluoruro se unen al calcio y al magnesio