
En química , un ladderano es una molécula orgánica que contiene dos o más anillos de ciclobutano fusionados. El nombre surge de la semejanza de una serie de anillos de ciclobutano fusionados con una escalera . Se han desarrollado numerosos enfoques sintéticos para la síntesis de compuestos ladderanos de varias longitudes. [1] Los mecanismos a menudo involucran fotocicloadiciones [2 + 2] , una reacción útil para crear anillos tensos de 4 miembros. Los ladderanos naturales se han identificado como componentes principales de la membrana anammoxosomal de la bacteria anammox , filo Planctomycetota . [2]
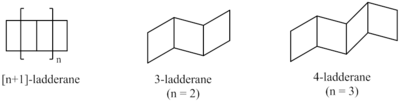
Los métodos sintéticos han dado como resultado ladderanos de longitudes variables. Se ha desarrollado un sistema de clasificación para describir los ladderanos en función del número de anillos consecutivos. [3] La longitud del ladderano se describe mediante el número entre paréntesis que precede a la palabra "ladderano". Este es igual al número de enlaces compartidos por dos ciclobutanos ( n ) más 1.
Un ladderano de 3 o más unidades puede conectarse en un círculo, formando una banda, que también puede considerarse como dos anillos de cicloalcano paralelos interconectados . Estos se denominan prismanos .

Los ladderanos tienen dos tipos de relaciones estereoquímicas . [3] Una describe la disposición relativa de los átomos de hidrógeno en la fusión entre dos anillos de ciclobutano. Estos átomos de hidrógeno pueden estar en configuración cis o trans . Los ladderanos trans no se han sintetizado debido a la tensión del anillo en estos compuestos.
La segunda relación estereoquímica describe la orientación de tres anillos de ciclobutano consecutivos y, por lo tanto, solo es relevante para los ladderanos de n ≥ 2. Los dos anillos externos pueden estar en la misma cara (sin-) o en la cara opuesta (anti-) del anillo central.
Se han utilizado varios métodos sintéticos para la síntesis de compuestos ladderanos en el laboratorio. Los tres enfoques principales son (1) la dimerización de los precursores de polieno , (2) la adición gradual, de uno o dos anillos a la vez, (3) y la oligomerización. [3] A continuación se describen varios ejemplos de síntesis de ladderanos.
La dimerización de dos ciclobutadienos puede generar productos tanto syn como antiladderano dependiendo de las condiciones de reacción. [4] El primer paso para formar el producto syn implica la generación de 1,3-ciclobutadieno mediante el tratamiento de cis-3,4-diclorociclobuteno con amalgama de sodio . El reactivo pasa a través de un intermedio metalado antes de formar 1,3-ciclobutadieno, que luego puede dimerizarse para formar el syn-dieno. La hidrogenación de los dobles enlaces formará el syn-[3]-ladderano saturado .
Para generar el producto anti, se trata el cis-3,4-diclorociclobuteno con amalgama de litio . [5] El derivado de litio sufre una reacción de acoplamiento CC para producir la estructura dimérica abierta. Este intermedio reacciona para formar el antidieno, que puede hidrogenarse para formar el producto final anti-[3]-ladderano.

Un enfoque sintético diferente desarrollado por Martin y colaboradores ha permitido la síntesis de [4]-ladderanos. [4] El paso inicial implica la formación de un [2]-ladderano a partir de la adición de dos equivalentes de anhídrido maleico con acetileno . Los dos anillos restantes se forman a partir de la contracción del anillo de Ramberg-Bäcklund .

Mehta y colaboradores han sintetizado ladderanos con longitudes de hasta 13 anillos de ciclobutano. [6] Este proceso implica la generación in situ de dicarbometoxiciclobutadieno a partir de su complejo Fe(CO) 3 a bajas temperaturas con la adición de nitrato de amonio cérico (IV) (CAN) . La generación del butadieno forma rápidamente una mezcla de [ n ]-ladderanos de longitudes de hasta n = 13 con un rendimiento general del 55%. Todos los ladderanos sintetizados a través de este método tienen una estructura cis, syn, cis. Esto puede ser el resultado de la dimerización inicial de dos ciclobutadienos que preferiblemente forman el producto syn, que se muestra a continuación. La dimerización posterior solo produce el producto anti debido a factores estéricos.

En estas reacciones, los ladderanos se forman a partir de múltiples fotocicloadiciones [2 + 2] entre los dobles enlaces de dos polienos. [7] Una complicación que surge de este enfoque es la reacción de los precursores a través de rutas de fotoexcitación alternativas más favorables . Estas reacciones secundarias se evitan mediante la adición de una unidad espaciadora química que mantiene los dos polienos paralelos entre sí, lo que solo permite que se produzcan cicloadiciones [2 + 2].
Un espaciador común utilizado en estas reacciones es el sistema [2.2]paraciclofano . Este es lo suficientemente rígido y puede mantener las colas de polieno lo suficientemente cerca para que se produzcan las cicloadiciones.

MacGillivray y sus colegas han demostrado que un enfoque supramolecular para la síntesis covalente en el entorno organizado y libre de solventes del estado sólido puede proporcionar una solución al problema de organizar dos polienos para una reacción intramolecular para dar un ladderano. Específicamente, al adoptar un enfoque para controlar la reactividad en sólidos mediante el uso de moléculas que sirven como plantillas lineales, han demostrado la utilidad de la cocristalización de resorcinol (1,3-bencenodiol), o un derivado, con un poli- m -eno todo- trans -bis(4-piridil) (4-pir-poli- m -eno) produce un ensamblaje molecular de cuatro componentes, 2(resorcinol)·2(4-pir-poli- m -eno), en el que cada resorcinol preorganiza, a través de dos interacciones de enlace de hidrógeno O—H···N, dos poli- m -enos para la fotoadición [2+2]. Los dos polienos se colocan mediante plantillas de tal manera que los enlaces C=C de las olefinas se encuentran paralelos y separados por < 4,2 Å, una posición adecuada para la fotorreacción. La irradiación UV del sólido produce el [ n ]ladderano deseado, con los enlaces C=C reaccionando para formar la estructura de ciclobutano fusionado. La irradiación UV de banda ancha de dos de estos conjuntos supramoleculares de cuatro componentes unidos por enlaces de hidrógeno proporciona los ladderanos correspondientes de forma estereoespecífica y con un rendimiento cuantitativo en cantidades de gramos. [8]

Los ladderanos se identificaron por primera vez en un grupo raro de bacterias oxidantes anaeróbicas de amonio ( anammox ) pertenecientes al filo Planctomycetota . Estas bacterias secuestran las reacciones catabólicas anammox en compartimentos intracelulares llamados anammoxosomas. [2] El proceso anammox implica la oxidación de amonio a gas nitrógeno con nitrito como aceptor final de electrones . Los intermediarios en este proceso son dos compuestos altamente tóxicos, hidrazina (N 2 H 4 ) e hidroxilamina (NH 2 OH). El proceso de oxidación implica la generación de un gradiente de protones en la cara intracitoplasmática del anammoxosoma. La disipación del gradiente de protones está acoplada a la fosforilación de ADP a través de ATPases unidas a la membrana . [9]
Los anammoxosomas están enriquecidos con los lípidos ladderanos que se muestran a la derecha. [10] El análisis de las membranas de los anammoxosomas de las especies bacterianas Brocadia anammoxidans y Kuenenia stuttgartiensis ha revelado que los ladderanos constituyen más del 50% de los lípidos de la membrana. La alta abundancia de lípidos ladderanos en el anammoxosoma da como resultado una membrana excepcionalmente densa con permeabilidad reducida. [11] La permeabilidad reducida puede disminuir la difusión pasiva de protones a través de la membrana que disiparía el gradiente electroquímico. Esto sería especialmente perjudicial para las bacterias anammox, debido al metabolismo relativamente lento de las anammox. También se ha planteado la hipótesis de que la permeabilidad reducida secuestra los intermediarios altamente tóxicos y mutagénicos, hidrazina e hidroxilamina, que pueden difundirse fácilmente a través de las biomembranas. La pérdida de estos intermediarios clave dañaría componentes celulares clave como el ADN , además de reducir la eficiencia catabólica de la célula.
Corey y colaboradores han sintetizado un lípido [5]-ladderano natural, llamado ácido pentacicloanamóxico . [12] El primer paso de esta reacción implica la bromación seguida de la ciclización del ciclooctatetraeno para formar un ciclohexadieno. Este ciclohexadieno queda atrapado por el azodicarboxilato de dibencilo. Se realizan modificaciones del grupo funcional para producir un ciclobutano que se elabora mediante una fotocicloadición [2+2] con una ciclopentenona para producir un segundo anillo de ciclobutano. La protección del grupo carbonilo , seguida de una reacción de extrusión de N 2 , produce dos anillos de ciclobutano fusionados más. El ciclobutano final se forma mediante una transposición de Wolff y la cadena de alquilo se instala mediante una olefinación de Wittig .
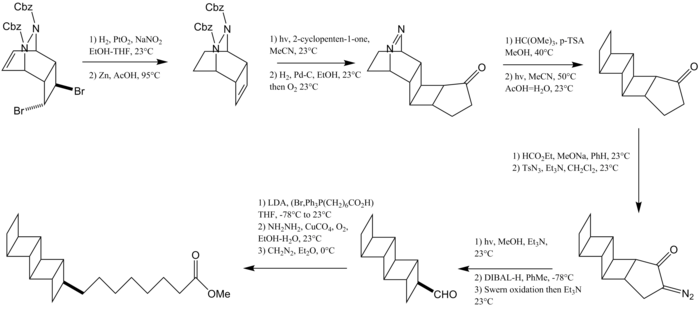
En 2016, Burns y sus colaboradores de la Universidad de Stanford informaron sobre una síntesis enantioselectiva de las colas lipídicas de [3]- y [5]-ladderano y su incorporación a un lípido de fosfatidilcolina completo . [13] Ambas rutas aprovechan un pequeño bloque de construcción de [2]-laddereno, el biciclo[2.2.0]hexeno, preparado mediante una reacción de Ramberg-Bäcklund . La ruta hacia un ácido graso que contiene [5]-ladderano implica la dimerización de este intermedio para formar un hidrocarburo totalmente anti [5]-ladderano. La cloración de C–H mediante un catalizador de porfirina de manganeso y la posterior eliminación introducen la insaturación para producir un [5]-laddereno. La hidroboración y una reacción de Zweifel instalan el grupo alquilo lineal.

La ruta hacia un alcohol graso [3]-ladderano comienza con una fotocicloadición [2+2] entre una benzoquinona bromada y biciclo[2.2.0]hexeno. La eliminación de H–Br y la adición de un compuesto de organocinc instalan el alcohol alquílico. Una reacción de desoxigenación mediada por hidrazina seguida de hidrogenación con el catalizador de Crabtree efectúa la reducción al anillo de ciclohexano.
