
La genómica comparativa es una rama de la investigación biológica que examina las secuencias del genoma en un espectro de especies , que abarca desde los humanos y los ratones hasta una amplia gama de organismos, desde las bacterias hasta los chimpancés . [2] [3] Este enfoque holístico a gran escala compara dos o más genomas para descubrir las similitudes y diferencias entre los genomas y estudiar la biología de los genomas individuales. [4] La comparación de secuencias del genoma completo proporciona una visión muy detallada de cómo se relacionan los organismos entre sí a nivel genético . Al comparar secuencias del genoma completo, los investigadores obtienen información sobre las relaciones genéticas entre organismos y estudian los cambios evolutivos . [2] El principio principal de la genómica comparativa es que las características comunes de dos organismos a menudo estarán codificadas dentro del ADN que se conserva evolutivamente entre ellos. Por lo tanto, la genómica comparativa proporciona una herramienta poderosa para estudiar los cambios evolutivos entre organismos, ayudando a identificar genes que se conservan o son comunes entre las especies, así como genes que dan características únicas de cada organismo. Además, estos estudios pueden realizarse en diferentes niveles de los genomas para obtener múltiples perspectivas sobre los organismos. [4]
El análisis genómico comparativo comienza con una comparación sencilla de las características generales de los genomas, como el tamaño del genoma, el número de genes y el número de cromosomas. La Tabla 1 presenta datos sobre varios organismos modelo completamente secuenciados y destaca algunos hallazgos sorprendentes. Por ejemplo, mientras que la pequeña planta con flores Arabidopsis thaliana tiene un genoma más pequeño que el de la mosca de la fruta Drosophila melanogaster (157 millones de pares de bases frente a 165 millones de pares de bases, respectivamente), posee casi el doble de genes (25.000 frente a 13.000). De hecho, A. thaliana tiene aproximadamente el mismo número de genes que los humanos (25.000). Por lo tanto, una lección muy temprana aprendida en la era genómica es que el tamaño del genoma no se correlaciona con el estado evolutivo, ni el número de genes es proporcional al tamaño del genoma. [5]
En genómica comparativa, la sintenia es el orden preservado de los genes en los cromosomas de especies relacionadas que indica su descendencia de un ancestro común . La sintenia proporciona un marco en el que se identifica la conservación de genes homólogos y el orden de los genes entre genomas de diferentes especies. [9] Los bloques de sintenia se definen más formalmente como regiones de cromosomas entre genomas que comparten un orden común de genes homólogos derivados de un ancestro común. [10] [11] Se han utilizado indistintamente nombres alternativos como sintenia conservada o colinealidad . [12] Las comparaciones de la sintenia genómica entre y dentro de las especies han proporcionado una oportunidad para estudiar los procesos evolutivos que conducen a la diversidad del número y la estructura de los cromosomas en muchos linajes a lo largo del árbol de la vida; [13] [14] Los primeros descubrimientos que utilizaron dichos enfoques incluyen regiones cromosómicas conservadas en nematodos y levaduras , [15] [16] la historia evolutiva y los rasgos fenotípicos de grupos de genes Hox extremadamente conservados en animales y la familia de genes MADS-box en plantas, [17] [18] y la evolución del cariotipo en mamíferos y plantas. [19]
Además, comparar dos genomas no solo revela dominios conservados o sintenia, sino que también ayuda a detectar variaciones en el número de copias , polimorfismos de un solo nucleótido (SNP) , indeles y otras variaciones estructurales genómicas .
La genómica comparativa , que prácticamente comenzó tan pronto como se dispuso de los genomas completos de dos organismos (es decir, los genomas de las bacterias Haemophilus influenzae y Mycoplasma genitalium ) en 1995, es ahora un componente estándar del análisis de cada nueva secuencia genómica. [2] [20] Con la explosión en el número de proyectos genómicos debido a los avances en las tecnologías de secuenciación de ADN , en particular los métodos de secuenciación de próxima generación a finales de la década de 2000, este campo se ha vuelto más sofisticado, lo que hace posible abordar muchos genomas en un solo estudio. [21] La genómica comparativa ha revelado altos niveles de similitud entre organismos estrechamente relacionados, como los humanos y los chimpancés, y, lo que es más sorprendente, similitud entre organismos aparentemente distantemente relacionados, como los humanos y la levadura Saccharomyces cerevisiae . [22] También ha demostrado la extrema diversidad de la composición genética en diferentes linajes evolutivos. [20]
Véase también : Historia de la genómica
La genómica comparativa tiene sus raíces en la comparación de genomas de virus a principios de los años 1980. [20] Por ejemplo, se compararon virus de ARN pequeños que infectaban animales ( picornavirus ) y aquellos que infectaban plantas ( virus del mosaico del caupí ) y se demostró que compartían una similitud de secuencia significativa y, en parte, el orden de sus genes. [23] En 1986, se publicó el primer estudio genómico comparativo a mayor escala, comparando los genomas del virus varicela-zóster y el virus de Epstein-Barr que contenían más de 100 genes cada uno. [24]
La primera secuencia completa del genoma de un organismo celular, el de Haemophilus influenzae Rd, se publicó en 1995. [25] El segundo artículo sobre secuenciación del genoma fue el de la pequeña bacteria parásita Mycoplasma genitalium , publicado el mismo año. [26] A partir de este artículo, los informes sobre nuevos genomas se convirtieron inevitablemente en estudios genómicos comparativos. [20]
Genomas microbianos. El primer sistema de comparación de genomas completos de alta resolución de genomas microbianos de 10-15 kbp fue desarrollado en 1998 por Art Delcher, Simon Kasif y Steven Salzberg y aplicado a la comparación de organismos microbianos completos altamente relacionados con sus colaboradores en el Instituto de Investigación Genómica (TIGR). El sistema se llama MUMMER y fue descrito en una publicación en Nucleic Acids Research en 1999. El sistema ayuda a los investigadores a identificar grandes reordenamientos, mutaciones de una sola base, reversiones, expansiones de repeticiones en tándem y otros polimorfismos. En las bacterias, MUMMER permite la identificación de polimorfismos que son responsables de la virulencia, patogenicidad y resistencia a los antibióticos. El sistema también se aplicó al Proyecto de Organismo Mínimo en TIGR y posteriormente a muchos otros proyectos de genómica comparativa.
Genomas eucariotas. Saccharomyces cerevisiae , la levadura de panadería, fue el primer eucariota en tener su secuencia genómica completa publicada en 1996. [27] Después de la publicación del genoma del gusano redondo Caenorhabditis elegans en 1998 [15] y junto con el genoma de la mosca de la fruta Drosophila melanogaster en 2000, [28] Gerald M. Rubin y su equipo publicaron un artículo titulado "Genómica comparativa de los eucariotas", en el que compararon los genomas de los eucariotas D. melanogaster , C. elegans y S. cerevisiae , así como el procariota H. influenzae . [29] Al mismo tiempo, Bonnie Berger , Eric Lander y su equipo publicaron un artículo sobre la comparación del genoma completo de humanos y ratones. [30]
Con la publicación en la década de 2000 de los grandes genomas de vertebrados, incluidos el humano , el pez globo japonés Takifugu rubripes y el ratón , se han publicado resultados precalculados de comparaciones de genomas grandes para su descarga o visualización en un navegador de genomas . En lugar de realizar sus propios análisis, la mayoría de los biólogos pueden acceder a estas grandes comparaciones entre especies y evitar la impracticabilidad causada por el tamaño de los genomas. [31]
Los métodos de secuenciación de nueva generación , que se introdujeron por primera vez en 2007, han producido una enorme cantidad de datos genómicos y han permitido a los investigadores generar múltiples borradores de secuencias genómicas (procariotas) a la vez. Estos métodos también pueden descubrir rápidamente polimorfismos , inserciones y deleciones de un solo nucleótido al mapear lecturas no ensambladas contra un genoma de referencia bien anotado y, de esta manera, proporcionar una lista de posibles diferencias genéticas que pueden ser la base de cualquier variación funcional entre cepas. [21]
Una característica de la biología es la evolución, la teoría de la evolución es también la base teórica de la genómica comparativa, y al mismo tiempo los resultados de la genómica comparativa enriquecieron y desarrollaron de manera sin precedentes la teoría de la evolución. Cuando se comparan dos o más secuencias del genoma, se pueden deducir las relaciones evolutivas de las secuencias en un árbol filogenético. Con base en una variedad de datos del genoma biológico y el estudio de los procesos de evolución vertical y horizontal, se pueden comprender partes vitales de la estructura genética y su función reguladora.
La similitud de genomas relacionados es la base de la genómica comparativa. Si dos criaturas tienen un ancestro común reciente, las diferencias entre los genomas de las dos especies se derivan del genoma de los ancestros. Cuanto más estrecha sea la relación entre dos organismos, mayores serán las similitudes entre sus genomas. Si existe una relación estrecha entre ellos, entonces su genoma mostrará un comportamiento lineal ( sintenia ), es decir, algunas o todas las secuencias genéticas se conservarán. Por lo tanto, las secuencias del genoma se pueden utilizar para identificar la función de los genes, analizando su homología (similitud de secuencia) con genes de función conocida.

Las secuencias ortólogas son secuencias relacionadas en diferentes especies: un gen existe en la especie original, la especie se divide en dos especies, por lo que los genes en la nueva especie son ortólogos a la secuencia en la especie original. Las secuencias paralógicas se separan mediante clonación de genes (duplicación de genes): si se copia un gen particular en el genoma, entonces la copia de las dos secuencias es paralógica al gen original. Un par de secuencias ortólogas se llama pares ortólogos (ortólogos), un par de secuencias paralógicas se llama pares colaterales (parálogos). Los pares ortólogos generalmente tienen la misma función o una similar, lo que no es necesariamente el caso de los pares colaterales. En los pares colaterales, las secuencias tienden a evolucionar hasta tener diferentes funciones.
La genómica comparativa explota tanto las similitudes como las diferencias en las proteínas , el ARN y las regiones reguladoras de diferentes organismos para inferir cómo ha actuado la selección sobre estos elementos. Aquellos elementos que son responsables de las similitudes entre diferentes especies deberían conservarse a través del tiempo ( selección estabilizadora ), mientras que aquellos elementos responsables de las diferencias entre especies deberían ser divergentes ( selección positiva ). Finalmente, aquellos elementos que no son importantes para el éxito evolutivo del organismo no estarán conservados (la selección es neutral).
Uno de los objetivos importantes de este campo es la identificación de los mecanismos de evolución del genoma eucariota. Sin embargo, a menudo se complica por la multiplicidad de eventos que han tenido lugar a lo largo de la historia de los linajes individuales, dejando solo rastros distorsionados y superpuestos en el genoma de cada organismo vivo. Por esta razón, los estudios de genómica comparativa de pequeños organismos modelo (por ejemplo, el modelo Caenorhabditis elegans y el estrechamente relacionado Caenorhabditis briggsae ) son de gran importancia para avanzar en nuestra comprensión de los mecanismos generales de la evolución. [32] [33]
La genómica comparativa desempeña un papel crucial en la identificación de variaciones en el número de copias (CNV) y la comprensión de su importancia en la evolución. Las CNV, que implican deleciones o duplicaciones de grandes segmentos de ADN, se reconocen como una fuente importante de diversidad genética , que influye en la estructura , la dosis y la regulación de los genes . Si bien los polimorfismos de un solo nucleótido (SNP) son más comunes, las CNV afectan a regiones genómicas más grandes y pueden tener efectos profundos en el fenotipo y la diversidad. [34] Estudios recientes sugieren que las CNV constituyen alrededor del 4,8 al 9,5 % del genoma humano y tienen un impacto funcional y evolutivo sustancial. En los mamíferos, las CNV contribuyen significativamente a la diversidad de la población, influyendo en la expresión genética y varios rasgos fenotípicos . [35] Los análisis genómicos comparativos de los genomas humanos y de chimpancés han revelado que las CNV pueden desempeñar un papel más importante en el cambio evolutivo en comparación con los cambios de un solo nucleótido. Las investigaciones indican que las CNV afectan a más nucleótidos que los cambios de pares de bases individuales, con aproximadamente el 2,7% del genoma afectado por las CNV en comparación con el 1,2% por los SNP. Además, aunque muchas CNV son compartidas entre humanos y chimpancés, una parte significativa es única para cada especie. Además, las CNV se han asociado con enfermedades genéticas en humanos, lo que destaca su importancia en la salud humana. A pesar de esto, muchas preguntas sobre las CNV siguen sin respuesta, incluido su origen y contribuciones a la adaptación evolutiva y la enfermedad. La investigación en curso tiene como objetivo abordar estas preguntas utilizando técnicas como la hibridación genómica comparativa , que permite un examen detallado de las CNV y su importancia. Cuando los investigadores examinaron los datos de secuencia sin procesar del humano y el chimpancé. [36]
La genómica comparativa tiene una profunda importancia en diversos campos, entre ellos la investigación médica, la biología básica y la conservación de la biodiversidad. Por ejemplo, en la investigación médica, predecir cómo las variantes genómicas limitan la capacidad de predecir qué variantes genómicas conducen a cambios en los fenotipos a nivel de organismo, como un mayor riesgo de enfermedades en los seres humanos, sigue siendo un desafío debido al inmenso tamaño del genoma, que comprende alrededor de tres mil millones de nucleótidos. [37] [38] [39]
Para hacer frente a este desafío, la genómica comparativa ofrece una solución al identificar las posiciones de nucleótidos que han permanecido inalteradas a lo largo de millones de años de evolución. Estas regiones conservadas indican sitios potenciales donde las alteraciones genéticas podrían tener efectos perjudiciales en la aptitud de un organismo, orientando así la búsqueda de variantes causantes de enfermedades. Además, la genómica comparativa promete desentrañar los mecanismos de la evolución genética, las adaptaciones ambientales, las diferencias específicas de género y las variaciones poblacionales en los linajes de vertebrados. [40]
Además, los estudios comparativos permiten la identificación de firmas genómicas de selección, regiones del genoma que han experimentado un aumento y fijación preferencial en las poblaciones debido a su importancia funcional en procesos específicos. [41] Por ejemplo, en genética animal, el ganado autóctono muestra una resistencia superior a las enfermedades y una adaptabilidad ambiental, pero una productividad menor en comparación con las razas exóticas. A través de análisis genómicos comparativos, se pueden identificar firmas genómicas significativas responsables de estos rasgos únicos. Usando información de esta firma, los criadores pueden tomar decisiones informadas para mejorar las estrategias de crianza y promover el desarrollo de la raza. [42]
Los métodos computacionales son necesarios para las comparaciones genómicas, dada la gran cantidad de datos codificados en los genomas. Actualmente, hay muchas herramientas disponibles públicamente, que van desde comparaciones de genomas completos hasta análisis de expresión genética . [43] Esto incluye métodos de sistemas y control, teoría de la información, análisis de cadenas y minería de datos. [44] Los métodos computacionales seguirán siendo fundamentales para la investigación y la enseñanza, especialmente cuando la ciencia de la información y la biología genómica se enseñen en conjunto. [45]

La genómica comparativa comienza con comparaciones básicas del tamaño del genoma y la densidad genética. Por ejemplo, el tamaño del genoma es importante para la capacidad de codificación y posiblemente por razones regulatorias. Una alta densidad genética facilita la anotación del genoma y el análisis de la selección ambiental. Por el contrario, una baja densidad genética dificulta el mapeo de enfermedades genéticas, como en el genoma humano.
Los alineamientos se utilizan para capturar información sobre secuencias similares, como ascendencia, descendencia evolutiva común o estructura y función comunes. Los alineamientos se pueden realizar tanto para secuencias de nucleótidos como de proteínas. [47] [48] Los alineamientos consisten en alineamientos por pares locales o globales y alineamientos de secuencias múltiples. Una forma de encontrar alineamientos globales es utilizar un algoritmo de programación dinámica conocido como algoritmo Needleman-Wunsch, mientras que el algoritmo Smith-Waterman se utiliza para encontrar alineamientos locales. Con el crecimiento exponencial de las bases de datos de secuencias y la aparición de secuencias más largas, existe un mayor interés en procedimientos de alineamiento más rápidos, aproximados o heurísticos. Entre estos, los algoritmos FASTA y BLAST son destacados para el alineamiento por pares local. En los últimos años hemos sido testigos del desarrollo de programas diseñados para alinear secuencias largas, como MUMmer (1999), BLASTZ (2003) y AVID (2003). Mientras que BLASTZ adopta un enfoque local, MUMmer y AVID están orientados al alineamiento global. Para aprovechar los beneficios de los enfoques de alineación tanto local como global, una estrategia eficaz consiste en integrarlos. Inicialmente, se emplea una variante rápida de BLAST conocida como BLAT para identificar regiones "de anclaje" homólogas. A continuación, se examinan estos anclajes para identificar conjuntos que exhiban un orden y una orientación conservados. A continuación, dichos conjuntos de anclajes se someten a alineación utilizando una estrategia global.
Además, los esfuerzos actuales se centran en optimizar los algoritmos existentes para manejar la gran cantidad de datos de secuencias genómicas mejorando su velocidad. Además, MAVID se destaca como otro programa de alineación por pares digno de mención, diseñado específicamente para alinear múltiples genomas.
Comparación por pares: la comparación por pares de datos de secuencias genómicas se utiliza ampliamente en la predicción comparativa de genes. Muchos estudios en genómica funcional comparativa se basan en comparaciones por pares, en las que los rasgos de cada gen se comparan con los rasgos de otros genes de distintas especies. Este método produce muchas más comparaciones que observaciones únicas, lo que hace que cada comparación dependa de otras. [49] [50]
Comparaciones múltiples: La comparación de múltiples genomas es una extensión natural de las comparaciones interespecíficas por pares. Estas comparaciones suelen tener como objetivo identificar regiones conservadas en dos escalas filogenéticas: 1. Las comparaciones profundas, a menudo denominadas huella filogenética [51], revelan la conservación en unidades taxonómicas superiores, como los vertebrados. [52] 2. Las comparaciones superficiales, recientemente denominadas sombra filogenética [53] , investigan la conservación en un grupo de especies estrechamente relacionadas.

El alineamiento de todo el genoma (WGA, por sus siglas en inglés) implica predecir las relaciones evolutivas a nivel de nucleótidos entre dos o más genomas. Integra elementos de alineamiento de secuencias colineales y predicción de ortología génica , lo que presenta un mayor desafío debido al gran tamaño y la naturaleza intrincada de los genomas completos. A pesar de su complejidad, han surgido numerosos métodos para abordar este problema porque los WGA desempeñan un papel crucial en varios análisis de todo el genoma, como la inferencia filogenética, la anotación del genoma y la predicción de funciones. [54] Por lo tanto, SyRI (Synteny and Rearrangement Identifier) es uno de esos métodos que utiliza el alineamiento de todo el genoma y está diseñado para identificar diferencias tanto estructurales como de secuencia entre dos ensamblajes de todo el genoma . Al tomar WGA como entrada, SyRI inicialmente escanea en busca de disparidades en las estructuras del genoma. Posteriormente, identifica variaciones de secuencia locales dentro de las regiones reordenadas y no reordenadas (sinténicas). [55]

Otro método computacional para la genómica comparativa es la reconstrucción filogenética. Se utiliza para describir las relaciones evolutivas en términos de ancestros comunes. Las relaciones suelen representarse en un árbol llamado árbol filogenético . De manera similar, la teoría de la coalescencia es un modelo retrospectivo para rastrear los alelos de un gen en una población hasta una única copia ancestral compartida por los miembros de la población. Esto también se conoce como el ancestro común más reciente . El análisis basado en la teoría de la coalescencia intenta predecir la cantidad de tiempo entre la introducción de una mutación y la distribución de un alelo o gen en particular en una población. Este período de tiempo es igual a cuánto tiempo hace que existió el ancestro común más reciente. Las relaciones de herencia se visualizan en una forma similar a un árbol filogenético. La coalescencia (o la genealogía de los genes) se puede visualizar utilizando dendrogramas . [56]

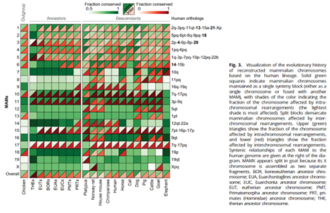
Un método adicional en la genómica comparativa es el mapeo genético . En el mapeo genético, visualizar la sintenia es una forma de ver el orden preservado de los genes en los cromosomas. Generalmente se utiliza para cromosomas de especies relacionadas, ambas resultantes de un ancestro común. [58] Este y otros métodos pueden arrojar luz sobre la historia evolutiva. Un estudio reciente utilizó la genómica comparativa para reconstruir 16 cariotipos ancestrales a lo largo de la filogenia de los mamíferos. La reconstrucción computacional mostró cómo los cromosomas se reorganizaron durante la evolución de los mamíferos. Brindó información sobre la conservación de regiones seleccionadas a menudo asociadas con el control de los procesos de desarrollo. Además, ayudó a proporcionar una comprensión de la evolución de los cromosomas y las enfermedades genéticas asociadas con los reordenamientos del ADN. [ cita requerida ]
Las herramientas computacionales para analizar secuencias y genomas completos se están desarrollando rápidamente debido a la disponibilidad de una gran cantidad de datos genómicos. Al mismo tiempo, las herramientas de análisis comparativo progresan y se mejoran. En los desafíos que plantean estos análisis, es muy importante visualizar los resultados comparativos. [59]
La visualización de la conservación de secuencias es una tarea difícil en el análisis comparativo de secuencias. Como sabemos, es muy ineficiente examinar la alineación de regiones genómicas largas de forma manual. Los navegadores genómicos basados en Internet proporcionan muchas herramientas útiles para investigar secuencias genómicas debido a que integran toda la información biológica basada en secuencias sobre las regiones genómicas. Cuando extraemos una gran cantidad de datos biológicos relevantes, pueden ser muy fáciles de usar y requieren menos tiempo. [59]
Una ventaja de utilizar herramientas en línea es que estos sitios web se desarrollan y actualizan constantemente. Hay muchas configuraciones y contenidos nuevos que se pueden utilizar en línea para mejorar la eficiencia. [59]
La agricultura es un campo que cosecha los beneficios de la genómica comparativa. Identificar los loci de los genes ventajosos es un paso clave en el mejoramiento de cultivos que están optimizados para un mayor rendimiento , rentabilidad, calidad y resistencia a las enfermedades . Por ejemplo, un estudio de asociación de todo el genoma realizado en 517 razas locales de arroz reveló 80 loci asociados con varias categorías de rendimiento agronómico, como el peso del grano, el contenido de amilosa y la tolerancia a la sequía . Muchos de los loci no habían sido caracterizados previamente. [74] Esta metodología no solo es poderosa, sino que también es rápida. Los métodos anteriores de identificación de loci asociados con el rendimiento agronómico requerían varias generaciones de mejoramiento cuidadosamente monitoreado de cepas parentales, un esfuerzo que consume mucho tiempo y que es innecesario para los estudios genómicos comparativos. [75]
El campo médico también se beneficia del estudio de la genómica comparativa. En un enfoque conocido como vaccinología inversa , los investigadores pueden descubrir antígenos candidatos para el desarrollo de vacunas analizando el genoma de un patógeno o una familia de patógenos. [76] La aplicación de un enfoque de genómica comparativa mediante el análisis de los genomas de varios patógenos relacionados puede conducir al desarrollo de vacunas que sean multiprotectoras. Un equipo de investigadores empleó dicho enfoque para crear una vacuna universal para Streptococcus del grupo B , un grupo de bacterias responsables de la infección neonatal grave . [77] La genómica comparativa también se puede utilizar para generar especificidad para vacunas contra patógenos que están estrechamente relacionados con microorganismos comensales. Por ejemplo, los investigadores utilizaron el análisis genómico comparativo de cepas comensales y patógenas de E. coli para identificar genes específicos de patógenos como base para encontrar antígenos que resulten en una respuesta inmune contra cepas patógenas pero no comensales. [78] En mayo de 2019, utilizando el Global Genome Set, un equipo del Reino Unido y Australia secuenció miles de aislamientos recolectados globalmente de Streptococcus del grupo A , proporcionando objetivos potenciales para desarrollar una vacuna contra el patógeno, también conocido como S. pyogenes . [79]
Medicina personalizada
La medicina personalizada , posibilitada por la genómica comparativa, representa un enfoque revolucionario en la atención médica, que adapta el tratamiento médico y la prevención de enfermedades a la composición genética de cada paciente. [80] Al analizar las variaciones genéticas en las poblaciones y compararlas con el genoma de un individuo, los médicos pueden identificar marcadores genéticos específicos asociados con la susceptibilidad a las enfermedades, el metabolismo de los fármacos y la respuesta al tratamiento. Al identificar variantes genéticas asociadas con las vías del metabolismo de los fármacos, los objetivos de los fármacos y las reacciones adversas , la medicina personalizada puede optimizar la selección de medicamentos, la dosis y los regímenes de tratamiento para pacientes individuales. Este enfoque minimiza el riesgo de reacciones adversas a los medicamentos, mejora la eficacia del tratamiento y mejora los resultados del paciente.
Cáncer
La genómica del cáncer representa un campo de vanguardia dentro de la oncología que aprovecha la genómica comparativa para revolucionar el diagnóstico, el tratamiento y las estrategias de prevención del cáncer . La genómica comparativa desempeña un papel crucial en la investigación del cáncer al identificar mutaciones impulsoras y proporcionar análisis integrales de mutaciones , alteraciones del número de copias , variantes estructurales, expresión genética y perfiles de metilación del ADN en estudios a gran escala en diferentes tipos de cáncer. Al analizar los genomas de las células cancerosas y compararlos con células sanas, los investigadores pueden descubrir alteraciones genéticas clave que impulsan la tumorigénesis , la progresión tumoral y la metástasis . Esta profunda comprensión del panorama genómico del cáncer tiene profundas implicaciones para la oncología de precisión . Además, la genómica comparativa es fundamental para dilucidar los mecanismos de resistencia a los medicamentos , un desafío importante en el tratamiento del cáncer.

Las células T (también conocidas como linfocitos T o timocitos) son células inmunes que crecen a partir de células madre en la médula ósea. Ayudan a defender el cuerpo de las infecciones y pueden ayudar en la lucha contra el cáncer. Debido a su parecido morfológico, fisiológico y genético con los humanos, los ratones y las ratas han sido durante mucho tiempo las especies preferidas para los modelos animales de investigación biomédica . La investigación en medicina comparativa se basa en la capacidad de utilizar la información de una especie para comprender los mismos procesos en otra. Podemos obtener nuevos conocimientos sobre las vías moleculares comparando las células T humanas y de ratón y sus efectos en el sistema inmunológico utilizando la genómica comparativa. Para comprender sus TCR y sus genes, Glusman realizó una investigación sobre la secuenciación de los loci del receptor de células T humanas y de ratón. Los genes TCR son bien conocidos y sirven como un recurso significativo para respaldar la genómica funcional y comprender cómo los genes y las regiones intergénicas del genoma contribuyen a los procesos biológicos. [81]
Los receptores inmunitarios de células T son importantes para ver el mundo de los patógenos en el sistema inmunitario celular. Una de las razones para secuenciar los loci TCR humanos y de ratón fue hacer coincidir las secuencias de la familia de genes ortólogos y descubrir áreas conservadas utilizando genómica comparativa. Se pensaba que estas reflejarían dos tipos de información biológica: (1) exones y (2) secuencias reguladoras . De hecho, la mayoría de los exones V, D, J y C podrían identificarse con este método. Las regiones variables están codificadas por múltiples elementos de ADN únicos que se reorganizan y conectan durante la diferenciación de las células T (TCR): elementos variables (V), de diversidad (D) y de unión (J) para los polipéptidos y ; y elementos V y J para los polipéptidos y . [Figura 1] Sin embargo, se habían mostrado varios bloques cortos no codificantes conservados del genoma. Tanto los motivos humanos como los de ratón están agrupados en gran medida en los 200 pb [Figura 2], se identificaron los potenciadores 3' conocidos en el TCR/ y posteriormente se demostró que una región conservada de 100 pb en el intrón J del ratón tenía una función reguladora.

Las comparaciones de las secuencias genómicas dentro de cada sitio físico o ubicación de un gen específico en un cromosoma (locs) y entre especies permiten la investigación de otros mecanismos y otras señales reguladoras. Algunos sugieren nuevas hipótesis sobre la evolución de los TCR, que se pondrán a prueba (y mejorarán) mediante la comparación con el complemento de genes TCR de otras especies de vertebrados. Una investigación genómica comparativa de humanos y ratones permitirá obviamente el descubrimiento y la anotación de muchos otros genes, así como la identificación de secuencias reguladoras en otras especies. [81]
La genómica comparativa también abre nuevas vías en otras áreas de investigación. A medida que la tecnología de secuenciación de ADN se ha vuelto más accesible, el número de genomas secuenciados ha aumentado. Con el aumento de la reserva de datos genómicos disponibles, la potencia de la inferencia genómica comparativa también ha crecido.
Un ejemplo notable de esta mayor potencia se encuentra en las recientes investigaciones sobre primates . Los métodos genómicos comparativos han permitido a los investigadores reunir información sobre la variación genética , la expresión genética diferencial y la dinámica evolutiva en primates que era imperceptible con los datos y métodos anteriores. [82]
El Proyecto Genoma del Gran Simio utilizó métodos genómicos comparativos para investigar la variación genética con referencia a las seis especies de grandes simios , encontrando niveles saludables de variación en su acervo genético a pesar de la disminución del tamaño de la población. [83] Otro estudio mostró que los patrones de metilación del ADN, que son un mecanismo de regulación conocido para la expresión genética, difieren en la corteza prefrontal de los humanos frente a los chimpancés, e implicó esta diferencia en la divergencia evolutiva de las dos especies. [84]