Cloruro de sodio / ˌ s oʊ d i ə m ˈ k l ɔːr aɪ d / , [8] comúnmente conocido como sal comestible , es un compuesto iónico con la fórmula química NaCl , que representa una proporción de 1:1 de iones de sodio y cloro . Es transparente o translúcido, quebradizo, higroscópico y se presenta como el mineral halita . En su forma comestible, se utiliza comúnmente como condimento y conservante de alimentos . Se utilizan grandes cantidades de cloruro de sodio en muchos procesos industriales, y es una fuente importante de compuestos de sodio y cloro utilizados como materias primas para síntesis químicas posteriores . Otra aplicación importante del cloruro de sodio es el descongelamiento de carreteras en climas bajo cero.
Además de los usos domésticos habituales de la sal, las aplicaciones más dominantes de la producción de aproximadamente 250 millones de toneladas por año (datos de 2008) incluyen productos químicos y descongelación. [9]
La sal se utiliza, directa o indirectamente, en la producción de muchos productos químicos, que consumen la mayor parte de la producción mundial. [10]
Es el punto de partida del proceso cloro-álcali , el proceso industrial para producir cloro e hidróxido de sodio , según la ecuación química
Esta electrólisis se lleva a cabo en una celda de mercurio, una celda de diafragma o una celda de membrana. Cada una de ellas utiliza un método diferente para separar el cloro del hidróxido de sodio. Se están desarrollando otras tecnologías debido al alto consumo de energía de la electrólisis, por lo que pequeñas mejoras en la eficiencia pueden tener grandes beneficios económicos. Algunas aplicaciones del cloro incluyen la producción de termoplásticos de PVC , desinfectantes y solventes.
El hidróxido de sodio se utiliza ampliamente en muchas industrias diferentes, permitiendo la producción de papel, jabón y aluminio, etc.
El cloruro de sodio se utiliza en el proceso Solvay para producir carbonato de sodio y cloruro de calcio . El carbonato de sodio, a su vez, se utiliza para producir vidrio , bicarbonato de sodio y colorantes , así como una gran variedad de otros productos químicos. En el proceso Mannheim , el cloruro de sodio se utiliza para la producción de sulfato de sodio y ácido clorhídrico .
El cloruro de sodio se utiliza mucho, por lo que incluso aplicaciones relativamente menores pueden consumir cantidades masivas. En la exploración de petróleo y gas , la sal es un componente importante de los fluidos de perforación en la perforación de pozos. [11] Se utiliza para flocular y aumentar la densidad del fluido de perforación para superar las altas presiones de gas en el fondo del pozo. Siempre que una perforadora golpea una formación de sal, se agrega sal al fluido de perforación para saturar la solución con el fin de minimizar la disolución dentro del estrato de sal. [9] La sal también se utiliza para aumentar el curado del hormigón en las carcasas cementadas. [10]
En el sector textil y de teñido, la sal se utiliza como enjuague de salmuera para separar contaminantes orgánicos, [12] para promover la "salinización" de precipitados de colorantes y para mezclar con colorantes concentrados para aumentar el rendimiento en los baños de teñido y hacer que los colores se vean más nítidos. Una de sus principales funciones es proporcionar la carga iónica positiva para promover la absorción de iones de colorantes con carga negativa. [10]
Para su uso en la industria de pulpa y papel , se utiliza para fabricar clorato de sodio , que luego se hace reaccionar con ácido sulfúrico y un agente reductor como el metanol para fabricar dióxido de cloro , un químico blanqueador que se usa ampliamente para blanquear pulpa de madera .
En el curtido y tratamiento del cuero, se agrega sal a las pieles de animales para inhibir la actividad microbiana en la parte inferior de las pieles y atraer la humedad nuevamente hacia ellas. [10]
En la fabricación de caucho, se utiliza sal para fabricar buna , neopreno y caucho blanco. La salmuera y el ácido sulfúrico se utilizan para coagular un látex emulsionado elaborado a partir de butadieno clorado . [10] [9]
También se añade sal para fijar el suelo y dar firmeza a los cimientos sobre los que se construyen las carreteras. La sal actúa para minimizar los efectos del desplazamiento causado en el subsuelo por los cambios de humedad y la carga de tráfico. [10]
El agua dura contiene iones de calcio y magnesio que interfieren con la acción del jabón y contribuyen a la acumulación de sarro o película de depósitos minerales alcalinos en los equipos y tuberías domésticos e industriales. Las unidades de ablandamiento de agua comerciales y residenciales utilizan resinas de intercambio iónico para eliminar los iones que causan la dureza. Estas resinas se generan y regeneran utilizando cloruro de sodio. [10] [9]
La segunda aplicación importante de la sal es la descongelación y el antihielo de las carreteras, tanto en los depósitos de sal como esparcidos por los vehículos de servicio de invierno . En previsión de las nevadas, lo mejor es "anticongelar" las carreteras con salmuera ( solución concentrada de sal en agua), que evita la adhesión entre la nieve y el hielo y la superficie de la carretera. Este procedimiento evita el uso excesivo de sal después de la nevada. Para descongelar, se utilizan mezclas de salmuera y sal, a veces con agentes adicionales como cloruro de calcio y/o cloruro de magnesio . El uso de sal o salmuera resulta ineficaz por debajo de los -10 °C (14 °F).

La sal para descongelar en el Reino Unido proviene principalmente de una sola mina en Winsford en Cheshire . Antes de la distribución se mezcla con <100 ppm de ferrocianuro de sodio como agente antiaglomerante , lo que permite que la sal de roca fluya libremente fuera de los vehículos de esparcido de sal a pesar de estar almacenada antes de su uso. En los últimos años, este aditivo también se ha utilizado en la sal de mesa. Otros aditivos se han utilizado en la sal de carretera para reducir los costos totales. Por ejemplo, en los EE. UU., una solución de carbohidratos subproducto del procesamiento de la remolacha azucarera se mezcló con sal de roca y se adhirió a las superficies de la carretera aproximadamente un 40% mejor que la sal de roca suelta sola. Debido a que permaneció en la carretera durante más tiempo, el tratamiento no tuvo que repetirse varias veces, lo que ahorró tiempo y dinero. [10]
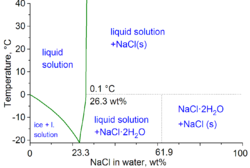
En términos técnicos de química física, el punto mínimo de congelación de una mezcla de agua y sal es de -21,12 °C (-6,02 °F) para un 23,31 % en peso de sal. Sin embargo, la congelación cerca de esta concentración es tan lenta que el punto eutéctico de -22,4 °C (-8,3 °F) se puede alcanzar con aproximadamente un 25 % en peso de sal. [13]
La sal de las carreteras acaba en los cuerpos de agua dulce y podría dañar a las plantas y animales acuáticos al alterar su capacidad de osmorregulación . [14] La omnipresencia de sal en las zonas costeras plantea un problema en cualquier aplicación de revestimiento , porque las sales atrapadas causan grandes problemas de adhesión. Las autoridades navales y los constructores de barcos controlan las concentraciones de sal en las superficies durante la construcción. Las concentraciones máximas de sal en las superficies dependen de la autoridad y la aplicación. La regulación de la OMI es la más utilizada y establece los niveles de sal en un máximo de 50 mg/m 2 de sales solubles medidas como cloruro de sodio. Estas mediciones se realizan mediante una prueba de Bresle . La salinización (aumento de la salinidad, también conocida como síndrome de salinización de agua dulce ) y el consiguiente aumento de la lixiviación de metales es un problema constante en toda América del Norte y las vías fluviales de Europa. [15]
En la descongelación de carreteras, la sal se ha asociado con la corrosión de los tableros de los puentes, los vehículos de motor, las barras y los alambres de refuerzo y las estructuras de acero desprotegidas utilizadas en la construcción de carreteras. La escorrentía superficial , la pulverización de vehículos y la sal arrastrada por el viento también afectan al suelo, la vegetación de los bordes de las carreteras y los suministros locales de agua superficial y subterránea. Aunque se han encontrado pruebas de la carga ambiental de sal durante el uso pico, las lluvias primaverales y los deshielos suelen diluir las concentraciones de sodio en el área donde se aplicó la sal. [10] Un estudio de 2009 descubrió que aproximadamente el 70% de la sal para carreteras que se aplica en el área metropolitana de Minneapolis-St Paul se retiene en la cuenca hidrográfica local. [16]
Algunas agencias están sustituyendo la sal de carretera por cerveza , melaza y jugo de remolacha . [17] Las aerolíneas utilizan más glicol y azúcar en lugar de soluciones a base de sal para descongelar . [18]
La sal se añade a los alimentos, ya sea por el productor de alimentos o por el consumidor, como potenciador del sabor, conservante, aglutinante, aditivo de control de la fermentación , agente de control de la textura y desarrollador de color. El consumo de sal en la industria alimentaria se subdivide, en orden descendente de consumo, en otros productos de procesamiento de alimentos, envasadores de carne, enlatados , panadería, lácteos y molinos de granos. La sal se añade para promover el desarrollo del color en tocino, jamón y otros productos cárnicos procesados. Como conservante, la sal inhibe el crecimiento de bacterias. La sal actúa como aglutinante en las salchichas para formar un gel aglutinante compuesto de carne, grasa y humedad. La sal también actúa como potenciador del sabor y como ablandador . [10]
Se utiliza como desecante barato y seguro debido a sus propiedades higroscópicas , lo que hace que la salazón sea un método eficaz de conservación de alimentos históricamente; la sal extrae agua de las bacterias a través de la presión osmótica , evitando que se reproduzcan, una de las principales fuentes de deterioro de los alimentos. Aunque existen desecantes más eficaces, pocos son seguros para la ingestión humana. Muchos microorganismos no pueden vivir en un entorno salado: el agua se extrae de sus células por ósmosis . Por este motivo, la sal se utiliza para conservar algunos alimentos, como el tocino, el pescado o el repollo.
En muchas industrias lácteas, la sal se añade al queso como agente de control del color, la fermentación y la textura. El subsector lácteo incluye empresas que fabrican mantequilla cremosa, leche condensada y evaporada, postres congelados, helados, queso natural y procesado y productos lácteos especiales. En el enlatado, la sal se añade principalmente como potenciador del sabor y conservante . También se utiliza como portador de otros ingredientes, agente deshidratante, inhibidor de enzimas y ablandador. En la panadería, la sal se añade para controlar la velocidad de fermentación en la masa de pan. También se utiliza para fortalecer el gluten (el complejo elástico de proteína-agua en ciertas masas) y como potenciador del sabor, como aderezo en productos horneados. La categoría de procesamiento de alimentos también incluye productos de molienda de granos. Estos productos consisten en la molienda de harina y arroz y la fabricación de alimentos de desayuno a base de cereales y harina mezclada o preparada. La sal también se utiliza como agente condimento, por ejemplo, en patatas fritas, pretzels y comida para perros y gatos. [10]
El cloruro de sodio se utiliza en medicina veterinaria como agente que provoca vómitos . Se administra en forma de solución saturada tibia. Los vómitos también pueden ser causados por la aplicación en la faringe de pequeñas cantidades de sal común o cristales de sal.
El cloruro de sodio se utiliza junto con agua como una de las principales soluciones para la terapia intravenosa . El aerosol nasal a menudo contiene una solución salina .
El cloruro de sodio también está disponible en forma de comprimidos orales y se toma para tratar niveles bajos de sodio. [19]

El cloruro de sodio es el principal agente extintor de incendios en los extintores de polvo seco que se utilizan en incendios de metales combustibles, como magnesio, circonio, titanio y litio (extintores de clase D). La sal forma una costra que excluye el oxígeno y sofoca el incendio. [20]
Desde al menos la época medieval , la sal se utiliza como agente limpiador para frotar las superficies del hogar. También se utiliza en muchas marcas de champú , pasta de dientes y, popularmente, para descongelar entradas de vehículos y zonas con hielo.
Los cristales de cloruro de sodio tienen una transmitancia de al menos el 90% (a través de 1 mm) para la luz infrarroja con longitudes de onda en el rango de 0,2 a 18 μm . [21] Se utilizaron en componentes ópticos como ventanas y lentes, donde existían pocas alternativas no absorbentes en ese rango espectral. Si bien son económicos, los cristales de NaCl son suaves e higroscópicos : cuando se exponen al agua en el aire ambiente, se cubren gradualmente con "escarcha". Esto limita la aplicación de NaCl a entornos secos, áreas selladas al vacío o usos a corto plazo como la creación de prototipos. Los materiales que son mecánicamente más fuertes y menos sensibles a la humedad, como el seleniuro de zinc y los vidrios de calcogenuro , se utilizan más ampliamente que el NaCl.

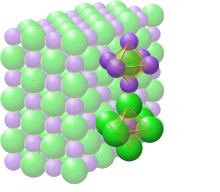
En el cloruro de sodio sólido, cada ion está rodeado por seis iones de carga opuesta como se espera en términos electrostáticos. Los iones circundantes se encuentran en los vértices de un octaedro regular . En el lenguaje del empaquetamiento compacto , los iones de cloruro más grandes (de 167 pm de tamaño [22] ) están dispuestos en una matriz cúbica, mientras que los iones de sodio más pequeños (de 116 pm [22] ) llenan todos los huecos cúbicos (huecos octaédricos) entre ellos. Esta misma estructura básica se encuentra en muchos otros compuestos y se conoce comúnmente como la estructura de NaCl o la estructura cristalina de sal de roca. Se puede representar como una red cúbica centrada en las caras (fcc) con una base de dos átomos o como dos redes cúbicas centradas en las caras que se interpenetran. El primer átomo se encuentra en cada punto de la red, y el segundo átomo se encuentra a medio camino entre los puntos de la red a lo largo del borde de la celda unitaria fcc.
El cloruro de sodio sólido tiene un punto de fusión de 801 °C y el cloruro de sodio líquido hierve a 1465 °C. Las imágenes de video en tiempo real con resolución atómica permiten visualizar la etapa inicial de la nucleación cristalina del cloruro de sodio. [23]
La conductividad térmica del cloruro de sodio en función de la temperatura tiene un máximo de 2,03 W/(cm·K) a 8 K (−265,15 °C; −445,27 °F) y disminuye a 0,069 a 314 K (41 °C; 106 °F). También disminuye con el dopaje . [24]
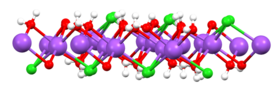
A partir de soluciones frías (por debajo del punto de congelación), la sal cristaliza con agua de hidratación como hidrohalito (el dihidrato NaCl·2 H 2 O ). [26]
En 2023, se descubrió que bajo presión, el cloruro de sodio puede formar los hidratos NaCl·8.5H 2 O y NaCl·13H 2 O. [27]
La atracción entre los iones Na + y Cl− en el sólido es tan fuerte que sólo los disolventes altamente polares como el agua disuelven bien el NaCl.
Cuando se disuelve en agua, la estructura del cloruro de sodio se desintegra a medida que los iones Na + y Cl− quedan rodeados por moléculas polares de agua. Estas soluciones consisten en un complejo acuoso metálico con la fórmula [Na(H2O ) 8 ] + , con una distancia Na–O de 250 pm . Los iones de cloruro también están fuertemente solvatados, y cada uno está rodeado por un promedio de seis moléculas de agua. [28] Las soluciones de cloruro de sodio tienen propiedades muy diferentes a las del agua pura. El punto eutéctico es de -21,12 °C (-6,02 °F) para una fracción de masa de sal del 23,31%, y el punto de ebullición de la solución de sal saturada está cerca de los 108,7 °C (227,7 °F). [13]
El pH de una solución de cloruro de sodio permanece ≈7 debido a la basicidad extremadamente débil del ion Cl − , que es la base conjugada del ácido fuerte HCl. En otras palabras, el NaCl no tiene efecto sobre el pH del sistema [29] en soluciones diluidas donde los efectos de la fuerza iónica y los coeficientes de actividad son insignificantes.
La sal común tiene una proporción molar de sodio y cloro de 1:1. En 2013, se descubrieron compuestos de sodio y cloruro de diferentes estequiometrías ; se predijeron cinco nuevos compuestos (por ejemplo, Na 3 Cl, Na 2 Cl, Na 3 Cl 2 , NaCl 3 y NaCl 7 ). La existencia de algunos de ellos se ha confirmado experimentalmente a altas presiones y otras condiciones: NaCl 3 cúbico y ortorrómbico, Na 3 Cl tetragonal metálico bidimensional y NaCl hexagonal exótico. [31] Esto indica que son posibles compuestos que violan la intuición química, en sistemas simples en condiciones no ambientales. [32]
La sal se encuentra en la corteza terrestre en forma de halita mineral (sal de roca) y existe una pequeña cantidad en forma de partículas de sal marina suspendidas en la atmósfera. [33] Estas partículas son los núcleos de condensación de nubes dominantes en alta mar, que permiten la formación de nubes en un aire que de otro modo no estaría contaminado . [34]
Actualmente, la sal se produce en masa mediante la evaporación de agua de mar o salmuera de pozos de salmuera y lagos salados . La extracción de sal de roca también es una fuente importante. China es el principal proveedor mundial de sal. [10] En 2017, la producción mundial se estimó en 280 millones de toneladas , siendo los cinco principales productores (en millones de toneladas) China (68,0), Estados Unidos (43,0), India (26,0), Alemania (13,0) y Canadá (13,0). [35] La sal también es un subproducto de la extracción de potasio .
La neutralización de un ácido fuerte y una base fuerte da como resultado una sal neutra.