
En química , el apilamiento pi (también llamado apilamiento π–π ) se refiere a las presuntas interacciones pi atractivas, no covalentes ( superposición orbital ) entre los enlaces pi de los anillos aromáticos . [1] Según algunos autores, el apilamiento directo de anillos aromáticos (la "interacción sándwich") es electrostáticamente repulsivo.
Lo que se observa con más frecuencia (ver figura a la derecha) es una interacción de apilamiento escalonado (desplazamiento paralelo) o en pi-tee (en forma de T perpendicular), ambas con atracción electrostática [2] [3] Por ejemplo, las interacciones observadas con mayor frecuencia entre anillos aromáticos de residuos de aminoácidos en proteínas es un apilamiento escalonado seguido de una orientación perpendicular. Las orientaciones en sándwich son relativamente raras. [4]
El apilamiento pi es repulsivo, ya que coloca átomos de carbono con cargas parcialmente negativas de un anillo sobre otros átomos de carbono parcialmente cargados negativamente del segundo anillo y átomos de hidrógeno con cargas parcialmente positivas sobre otros átomos de hidrógeno que también tienen cargas parcialmente positivas. [2] En el apilamiento escalonado, uno de los dos anillos aromáticos se desplaza lateralmente de modo que los átomos de carbono con carga parcialmente negativa en el primer anillo se colocan por encima de los átomos de hidrógeno con carga parcialmente positiva en el segundo anillo, de modo que las interacciones electrostáticas se vuelven atractivas. Del mismo modo, las interacciones pi-tee en las que los dos anillos están orientados perpendicularmente entre sí son electrostáticamente atractivas, ya que colocan átomos de hidrógeno parcialmente cargados positivamente en estrecha proximidad a átomos de carbono parcialmente cargados negativamente. Una explicación alternativa para la preferencia por el apilamiento escalonado se debe al equilibrio entre las interacciones de van der Waals ( dispersión atractiva más repulsión de Pauli ). [5]
Estas interacciones de apilamiento escalonado y de π-teeing entre anillos aromáticos son importantes en el apilamiento de nucleobases dentro de las moléculas de ADN y ARN , el plegamiento de proteínas , la síntesis dirigida por plantillas , la ciencia de los materiales y el reconocimiento molecular . A pesar del amplio uso del término apilamiento pi en la literatura científica, no existe una justificación teórica para su uso. [2]
El dímero de benceno es el sistema prototípico para el estudio del apilamiento pi, y está unido experimentalmente por 8–12 kJ/mol (2–3 kcal/mol) en la fase gaseosa con una separación de 4,96 Å entre los centros de masa para el dímero en forma de T. La pequeña energía de enlace hace que el dímero de benceno sea difícil de estudiar experimentalmente, y el dímero en sí solo es estable a bajas temperaturas y es propenso a agruparse. [6]
Otra evidencia contra el apilamiento de pi proviene de la cristalografía de rayos X. Se pueden observar configuraciones perpendiculares y paralelas desplazadas en las estructuras cristalinas de muchos compuestos aromáticos simples. [6] Se observaron geometrías paralelas desplazadas o perpendiculares similares en un estudio de estructuras cristalinas de proteínas de rayos X de alta resolución en el Protein Data Bank . [7] El análisis de los aminoácidos aromáticos fenilalanina, tirosina, histidina y triptófano indica que los dímeros de estas cadenas laterales tienen muchas interacciones estabilizadoras posibles a distancias mayores que los radios de van der Waals promedio. [4]
Las geometrías preferidas del dímero de benceno se han modelado a un alto nivel teórico con cálculos MP2-R12/A y conjuntos de bases aug-cc-PVTZ corregidos por contrapeso muy grandes. [6] Las dos conformaciones más estables son la desplazada paralela y la en forma de T, que son esencialmente isoenergéticas. Por el contrario, la configuración sándwich maximiza la superposición del sistema pi, lo que desestabiliza la interacción. La configuración sándwich representa un punto de silla energético, lo que es coherente con la rareza relativa de esta configuración en los datos de cristales de rayos X. [ cita requerida ]

Las energías de enlace relativas de estas tres configuraciones geométricas del dímero de benceno se pueden explicar por un equilibrio de fuerzas de dispersión de London y cuadrupolo/cuadrupolo . Si bien el benceno no tiene un momento dipolar, tiene un fuerte momento cuadrupolo . [8] El dipolo C–H local significa que hay una carga positiva en los átomos del anillo y una carga negativa correspondiente que representa una nube de electrones por encima y por debajo del anillo. El momento cuadrupolo se invierte para el hexafluorobenceno debido a la electronegatividad del flúor. El dímero de benceno en la configuración sándwich se estabiliza mediante fuerzas de dispersión de London, pero se desestabiliza mediante interacciones repulsivas cuadrupolo/cuadrupolo. Al desplazar uno de los anillos de benceno, la configuración desplazada en paralelo reduce estas interacciones repulsivas y se estabiliza. La gran polarizabilidad de los anillos aromáticos conduce a interacciones dispersivas como contribución principal a los efectos de apilamiento. Estos juegan un papel importante para las interacciones de nucleobases, por ejemplo, en el ADN . [9] La configuración en forma de T ofrece interacciones cuadrupolo/cuadrupolo favorables, ya que el cuadrupolo positivo de un anillo de benceno interactúa con el cuadrupolo negativo del otro. Los anillos de benceno están más separados en esta configuración, por lo que las interacciones cuadrupolo/cuadrupolo favorables evidentemente compensan las fuerzas de dispersión reducidas .
La capacidad de ajustar con precisión las interacciones de apilamiento de pi sería útil en numerosos esfuerzos sintéticos. Un ejemplo sería aumentar la afinidad de unión de un inhibidor de molécula pequeña a un bolsillo enzimático que contiene residuos aromáticos. Los efectos de los heteroátomos [7] y los sustituyentes en las interacciones de apilamiento de pi son difíciles de modelar y son un tema de debate.
Hunter y Sanders propusieron un modelo temprano para el papel de los sustituyentes en las interacciones de apilamiento pi. [10] Utilizaron un modelo matemático simple basado en cargas atómicas sigma y pi, orientaciones relativas e interacciones de van der Waals para determinar cualitativamente que la electrostática es dominante en los efectos de los sustituyentes. Según su modelo, los grupos atractores de electrones reducen el cuadrupolo negativo del anillo aromático y, por lo tanto, favorecen las conformaciones desplazadas en paralelo y en sándwich. Por el contrario, los grupos donadores de electrones aumentan el cuadrupolo negativo, lo que puede aumentar la fuerza de interacción en una configuración en forma de T con la geometría adecuada. Basándose en este modelo, los autores propusieron un conjunto de reglas que regulan las interacciones de apilamiento pi que prevalecieron hasta que se aplicaron cálculos más sofisticados. [ cita requerida ]
Siegel et al. proporcionaron evidencia experimental del modelo de Hunter-Sanders utilizando una serie de sin- y anti-1,8-di- o -tolilnaftalenos sustituidos. [11] En estos compuestos, los grupos arilo "se enfrentan" en una geometría apilada debido al hacinamiento estérico, y la barrera a la epimerización se midió mediante espectroscopia de resonancia magnética nuclear . Los autores informaron que los anillos arilo con sustituyentes que atraen electrones tenían mayores barreras a la rotación. La interpretación de este resultado fue que estos grupos redujeron la densidad electrónica de los anillos aromáticos, lo que permitió interacciones de apilamiento de sándwich pi más favorables y, por lo tanto, una barrera más alta. En otras palabras, los grupos que atraen electrones dieron como resultado interacciones electrostáticas "menos desfavorables" en el estado fundamental. [ cita requerida ]

Hunter et al. aplicaron un ciclo químico de doble mutación más sofisticado con una "cremallera" unida por enlaces de hidrógeno al problema de los efectos de los sustituyentes en las interacciones de apilamiento de pi. [12] Esta técnica se ha utilizado para estudiar una multitud de interacciones no covalentes. La mutación simple, en este caso el cambio de un sustituyente en un anillo aromático, produce efectos secundarios, como un cambio en la fuerza del enlace de hidrógeno . La mutación doble cuantifica estas interacciones secundarias, de modo que incluso una interacción débil de interés puede diseccionarse de la matriz. Sus resultados indican que los sustituyentes que más atraen electrones tienen interacciones de apilamiento de pi menos repulsivas. En consecuencia, esta tendencia se invirtió exactamente para las interacciones con pentafluorofenilbenceno, que tiene un momento cuadrupolar igual en magnitud pero opuesto en signo al del benceno. [8] Los hallazgos proporcionan evidencia directa del modelo de Hunter-Sanders. Sin embargo, las interacciones de apilamiento medidas utilizando el método de doble mutación fueron sorprendentemente pequeñas, y los autores señalan que los valores pueden no ser transferibles a otros sistemas.
En un estudio posterior, Hunter et al. verificaron en una primera aproximación que las energías de interacción de los anillos aromáticos en interacción en un ciclo mutante doble están dominadas por efectos electrostáticos. [13] Sin embargo, los autores señalan que las interacciones directas con los sustituyentes del anillo, que se analizan a continuación, también realizan contribuciones importantes. De hecho, la interacción de estos dos factores puede dar lugar al complicado comportamiento dependiente de los sustituyentes y la geometría de las interacciones de apilamiento pi.
El modelo Hunter-Sanders ha sido criticado por numerosos grupos de investigación que ofrecen evidencia experimental y computacional contradictoria de interacciones de apilamiento pi que no están gobernadas principalmente por efectos electrostáticos. [14]
La evidencia experimental más clara contra los efectos de los sustituyentes electrostáticos fue reportada por Rashkin y Waters. [15] Utilizaron bromuros de N-bencil-2-(2-fluorofenil)-piridinio meta- y para-sustituidos, que se apilan en una conformación desplazada paralela, como un sistema modelo para interacciones de apilamiento pi. En su sistema, un enlace de metileno prohíbe las interacciones favorables en forma de T. Como en modelos anteriores, la fuerza relativa de las interacciones de apilamiento pi se midió por RMN como la tasa de rotación alrededor del enlace biarilo, ya que las interacciones de apilamiento pi se interrumpen en el estado de transición . Los anillos para-sustituidos tenían pequeñas barreras rotacionales que aumentaban con grupos cada vez más atractores de electrones, en consonancia con hallazgos anteriores. Sin embargo, los anillos meta-sustituidos tenían barreras de rotación mucho más grandes a pesar de tener densidades electrónicas casi idénticas en el anillo aromático. Los autores explican esta discrepancia como la interacción directa del borde de los átomos de hidrógeno de un anillo con los sustituyentes electronegativos en el otro anillo. Esta afirmación está respaldada por datos de desplazamiento químico del protón en cuestión. [ cita requerida ]
Gran parte de los análisis detallados de las contribuciones relativas de los factores en el apilamiento pi han sido confirmados por computación. Sherill y Sinnokrot informaron un hallazgo sorprendente utilizando la teoría de alto nivel de que todos los dímeros de benceno sustituidos tienen interacciones de enlace más favorables que un dímero de benceno en la configuración sándwich. [16] El trabajo computacional posterior del grupo de Sherill reveló que los efectos de los sustituyentes para la configuración sándwich son aditivos, lo que apunta a una fuerte influencia de las fuerzas de dispersión y las interacciones directas entre los sustituyentes. [17] Se observó que las interacciones entre bencenos sustituidos en la configuración en forma de T eran más complejas. Finalmente, Sherill y Sinnokrot argumentan en su artículo de revisión que cualquier apariencia de una tendencia basada en sustituyentes que donan o retiran electrones puede explicarse por términos de intercambio-repulsión y dispersión. [18]

Houk y Wheeler también proporcionan evidencia computacional convincente de la importancia de la interacción directa en el apilamiento pi. [19] En su análisis de dímeros de benceno sustituidos en una conformación tipo sándwich, pudieron recapitular sus hallazgos utilizando un modelo extremadamente simple donde el benceno sustituido, Ph–X, fue reemplazado por H–X. Sorprendentemente, este modelo crudo resultó en la misma tendencia en energías de interacción relativas, y se correlacionó fuertemente con los valores calculados para Ph–X. Este hallazgo sugiere que los efectos de los sustituyentes en el dímero de benceno se deben a la interacción directa del sustituyente con el anillo aromático, y que el sistema pi del benceno sustituido no está involucrado. Este último punto se amplía a continuación.
En resumen, parecería que las contribuciones relativas de la electrostática, la dispersión y las interacciones directas a los efectos de los sustituyentes observados en las interacciones de apilamiento de pi dependen en gran medida de la geometría y el diseño experimental. La falta de consenso sobre el tema puede reflejar simplemente la complejidad del asunto.
La interpretación convencional del apilamiento pi implica interacciones cuadrupolares entre electrones deslocalizados en orbitales p. En otras palabras, debería ser necesaria la aromaticidad para que se produzca esta interacción. Sin embargo, varios grupos han aportado pruebas contrarias, lo que pone en tela de juicio si el apilamiento pi es un fenómeno exclusivo o si se extiende a otras moléculas neutras de capa cerrada.
En un experimento no muy diferente de otros mencionados anteriormente, Paliwal y coautores construyeron un balance de torsión molecular a partir de un éster de arilo con dos estados conformacionales. [20] El estado plegado tenía una interacción de apilamiento pi bien definida con una geometría en forma de T, mientras que el estado desplegado no tenía interacciones arilo-arilo. Los desplazamientos químicos de RMN de las dos conformaciones eran distintos y podían usarse para determinar la relación de los dos estados, que se interpretó como una medida de fuerzas intramoleculares. Los autores informan que una preferencia por el estado plegado no es exclusiva de los ésteres de arilo. Por ejemplo, el éster de ciclohexilo favoreció el estado plegado más que el éster de fenilo, y el éster de terc-butilo favoreció el estado plegado con una preferencia mayor que la mostrada por cualquier éster de arilo. Esto sugiere que la aromaticidad no es un requisito estricto para la interacción favorable con un anillo aromático.
Otras evidencias de los resultados de las interacciones de apilamiento de pi no aromáticos incluyen estudios críticos en química teórica, que explican los mecanismos subyacentes de las observaciones empíricas. Grimme informó que las energías de interacción de los dímeros más pequeños que consisten en uno o dos anillos son muy similares para los compuestos aromáticos y saturados. [21] Este hallazgo es de particular relevancia para la biología y sugiere que la contribución de los sistemas pi a fenómenos como las nucleobases apiladas puede estar sobreestimada. Sin embargo, se demostró que se observa una mayor interacción estabilizadora para los dímeros aromáticos grandes. Como se señaló anteriormente, esta energía de interacción depende en gran medida de la geometría. De hecho, los dímeros aromáticos grandes solo se estabilizan en relación con sus contrapartes saturadas en una geometría de sándwich, mientras que sus energías son similares en una interacción en forma de T.
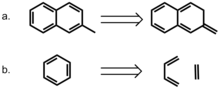
Bloom y Wheeler [22] adoptaron un enfoque más directo para modelar el papel de la aromaticidad. Los autores compararon las interacciones entre el benceno y el 2-metilnaftaleno o su isómero no aromático, el 2-metilen-2,3-dihidronaftaleno. Este último compuesto proporciona un medio para conservar el número de electrones p, pero elimina los efectos de la deslocalización. Sorprendentemente, las energías de interacción con el benceno son más altas para el compuesto no aromático, lo que sugiere que la localización del enlace pi es favorable en las interacciones de apilamiento pi. Los autores también consideraron una disección homodesmótica del benceno en etileno y 1,3-butadieno y compararon estas interacciones en un sándwich con benceno. Su cálculo indica que la energía de interacción entre el benceno y el benceno homodesmótico es más alta que la de un dímero de benceno tanto en la conformaciones sándwich como en la desplazada en paralelo, lo que nuevamente resalta la favorabilidad de las interacciones localizadas del enlace pi. Estos resultados sugieren firmemente que la aromaticidad no es necesaria para las interacciones de apilamiento pi en este modelo.
Incluso a la luz de esta evidencia, Grimme concluye que el apilamiento pi de hecho existe. [21] Sin embargo, advierte que los anillos más pequeños, particularmente aquellos en conformaciones en forma de T, no se comportan de manera significativamente diferente de sus contrapartes saturadas, y que el término debería especificarse para anillos más grandes en conformaciones apiladas que sí parecen exhibir un efecto de electrón pi cooperativo.

Una demostración de apilamiento se encuentra en el buckycatcher . [23] Esta pinza molecular se basa en dos buckybowls cóncavos con un ajuste perfecto para una molécula de fulereno convexo . La formación de complejos se produce simplemente evaporando una solución de tolueno que contiene ambos compuestos. En solución, se mide una constante de asociación de 8600 M −1 en función de los cambios en los desplazamientos químicos de RMN . [ cita requerida ]

El apilamiento de pi es frecuente en las estructuras cristalinas de las proteínas y también contribuye a las interacciones entre moléculas pequeñas y proteínas. Como resultado, las interacciones pi-pi y catión-pi son factores importantes en el diseño racional de fármacos. [24] Un ejemplo es el inhibidor de la acetilcolinesterasa (AChE) tacrina, aprobado por la FDA , que se utiliza en el tratamiento de la enfermedad de Alzheimer . Se propone que la tacrina tiene una interacción de apilamiento de pi con el anillo indólico de Trp84, y esta interacción se ha explotado en el diseño racional de nuevos inhibidores de la AChE. [25]

Incluso se han probado varias variantes de fenilos coordinados en pi utilizando metales de transición para apilar η 6 -feniltropanos , utilizando ciclopentadienilo y tricarbonilo en lugar de un benceno. Lo que en el caso del tricarbonilo duplicó la afinidad del compuesto por su sitio de ligando previsto (lo que se postula como debido a que las influencias electrostáticas resultantes son más propicias para el objetivo). [26]

Los sistemas π son bloques de construcción en el ensamblaje supramolecular porque a menudo participan en interacciones no covalentes. Un ejemplo de interacciones π–π en el ensamblaje supramolecular es la síntesis de catenano . El principal desafío para la síntesis de catenano es entrelazar moléculas de manera controlada. Stoddart y sus colaboradores desarrollaron una serie de sistemas que utilizan las fuertes interacciones π–π entre derivados de benceno ricos en electrones y anillos de piridinio pobres en electrones. [27] [2]El cataneno se sintetizó haciendo reaccionar bis(piridinio) ( A ), bisparafenileno-34-corona-10 ( B ) y 1, 4-bis(bromometil)benceno ( C ) (Fig. 2). La interacción π–π entre A y B dirigió la formación de un intermediario de plantilla entrelazado que se cicló aún más mediante una reacción de sustitución con el compuesto C para generar el producto [2]catenano.