El hexafosfabenceno es un análogo isoelectrónico de valencia del benceno y se espera que tenga una estructura planar similar debido a la estabilización por resonancia y su naturaleza sp2. Aunque varios otros alótropos del fósforo son estables , no se ha informado de ninguna evidencia de la existencia de P 6 . Se realizaron cálculos preliminares ab initio sobre la trimerización de P 2 que conduce a la formación del P 6 cíclico , y se predijo que el hexafosfabenceno se descompondría en P 2 libre con una barrera de energía de 13−15,4 kcal mol −1 , [1] y, por lo tanto, no se observaría en el estado no complejado en condiciones experimentales normales. La presencia de un disolvente añadido , como el etanol , podría conducir a la formación de enlaces de hidrógeno intermoleculares que pueden bloquear la interacción desestabilizadora entre pares solitarios de fósforo y, en consecuencia, estabilizar P 6 . [1] La barrera moderada sugiere que el hexafosfabenceno podría sintetizarse a partir de una cicloadición [2+2+2] de tres moléculas P 2 . [2] Actualmente, este es un esfuerzo sintético que aún queda por conquistar.

El aislamiento del hexafosfabenceno se logró por primera vez dentro de un complejo sándwich de tres niveles en 1985 por Scherer et al. Los cristales de color ámbar y estables al aire de [{(η 5 - Me 5 C 5 ) Mo } 2 (μ,η 6 -P 6 )] se forman por reacción de [CpMo(CO) 2 / 3 ] 2 con exceso de P 4 en dimetilbenceno , aunque con un rendimiento de aproximadamente el 1%. [ aclaración necesaria ] [3] [4] La estructura cristalina de este complejo es una molécula centrosimétrica , y tanto los anillos de cinco miembros como el anillo central de ligando-puente P 6 son planos y paralelos. La distancia P–P promedio para el hexafosfabenceno dentro de este complejo es de 2,170 Å. [3] [5]
Treinta años después, Fleischmann et al. mejoraron el rendimiento sintético de [{(η 5 -Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] hasta un 64%. Esto se logró aumentando la temperatura de reacción de la termólisis de [CpMo(CO) 2 / 3 ] 2 con P 4 a aproximadamente 205 °C en diisopropilbenceno hirviendo , favoreciendo así la formación de [{(η 5 -Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] como producto termodinámico. [6]
También se han descrito varios análogos de este complejo de tres niveles P 6 en los que se ha variado el metal de coordinación y el ligando η 5 . Entre ellos se incluyen complejos de tres niveles P 6 para Ti , V , Nb y W , en los que el método sintético todavía se basa en la termólisis de [CpM(CO) 2 / 3 ] 2 con P 4 , de la que se informó originalmente . [7] [8] [9] [10] [11]

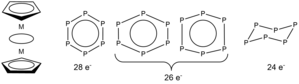
Si se considera el anillo planar P 6 como un ligando donador de electrones 6π , entonces [{(η 5 -Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] es un complejo sándwich de tres niveles con 28 electrones de valencia . Si se toma P 6 , similar a C 6 H 6 , como un donador de electrones 10π , se puede obtener un conteo de electrones de 32. En la mayoría de los complejos de tres niveles con un conteo de electrones que varía de 26 a 34, la estructura del anillo medio es planar ([{(η 5 -Cp)M} 2 (μ,η 6 -P 6 )] con M = Mo, Sc, Y, Zr, Hf, V, Nb, Ta, Cr y W). [12] [13] Sin embargo, en el complejo de 24 electrones de valencia [{(η 5 -Cp)Ti} 2 (μ,η 6 -P 6 )], se observa una distorsión y el anillo P 6 se frunce. [7]
Los cálculos han concluido que los orbitales 2a* y 2b* completamente llenos en complejos de 28 electrones de valencia conducen a un anillo medio simétrico y planar de P 6 . En complejos de 26 electrones de valencia , la ocupación de 2a* o 2b* da como resultado distorsiones en el plano o bisalílicas y un anillo medio planar asimétrico. El fruncimiento de P 6 en complejos de 24 electrones de valencia se debe a la estabilización de 5a, así como a la conferida por el estado de oxidación tetravalente de Ti en [{(η 5 -Cp)Ti} 2 (μ,η 6 -P 6 )]. [7] [14]

La reactividad de [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] hacia las sales monocatiónicas de plata y cobre del anión débilmente coordinante [Al{OC(CF 3 ) 3 } 4 ] − ([TEF]) fue estudiada por Fleischmann et al. en 2015. [6] La adición de una solución de Ag[TEF] o Cu[TEF] a una solución de [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] en cloroformo da como resultado la oxidación del complejo, que se puede observar por un cambio de color inmediato de ámbar a verde azulado oscuro. El momento magnético de los cristales verde azulado oscuro determinado por el método de RMN de Evans es igual a 1,67 μB, lo que es consistente con un electrón desapareado. En consecuencia, [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] + se detecta mediante espectrometría de masas ESI .
La estructura cristalina del producto verde azulado muestra que la geometría de tres pisos se conserva durante la oxidación de un electrón de [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )]. La longitud de enlace Mo—Mo del catión [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] + es 2,6617(4) Å; casi idéntica a la longitud de enlace determinada para las especies no oxidadas en 2,6463(3) Å. Sin embargo, las longitudes de enlace P—P se ven fuertemente afectadas por la oxidación . Mientras que los enlaces P1—P1′ y P3—P3′ se alargan, los enlaces P—P restantes se acortan en comparación con la longitud de enlace P—P promedio de aproximadamente 2,183 Å en las especies no oxidadas. Por lo tanto, la capa intermedia del complejo de 27 electrones de valencia [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] + se puede describir mejor como un ligando P 6 distorsionado bisalílico , intermedio entre los complejos de 28 electrones de valencia con un anillo simétrico perfectamente planar y aquellos con 26 electrones de valencia que muestran una distorsión en el plano más amplificada. Los cálculos del teorema funcional de la densidad (DFT) confirman que esta distorsión se debe a la despoblación de los orbitales de enlace P tras la oxidación del complejo sándwich de tres capas . [6]

Para evitar la oxidación de [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )], se realizaron reacciones adicionales en tolueno para disminuir el potencial redox de los cationes. Esto dio como resultado un producto de coordinación de color naranja brillante tras la reacción con cobre , aunque se obtuvo una mezcla que también contenía el producto de oxidación de color verde azulado oscuro tras la reacción con plata .
El análisis de rayos X de monocristal revela que este producto muestra un entorno de coordinación cuadrado-planar distorsionado alrededor del catión central a través de dos enlaces P—P coordinados en los laterales. Las distancias Ag—P son aproximadamente 2,6 Å, mientras que las distancias Cu—P se determinan en aproximadamente 2,4 Å. Por lo tanto, los enlaces P—P se alargan a 2,2694(16) Å y 2,2915(14) Å tras la coordinación con cobre y plata , respectivamente, mientras que los enlaces P—P restantes no se ven afectados.
En otro experimento, se trata Cu[TEF] con [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] en tolueno puro y la solución muestra el color naranja brillante del catión complejo [Cu([{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )]) 2 ] + . Sin embargo, el análisis de los cristales de esta solución revela un entorno de coordinación tetraédrica distorsionado alrededor del Cu. Las distancias Cu—P resultantes son algo más cortas que sus contrapartes discutidas anteriormente. Los enlaces P—P de coordinación son un poco más largos, lo que se atribuye a un menor hacinamiento estérico en la geometría de coordinación tetraédrica alrededor del centro de Cu.
Por lo tanto, es posible aislar con éxito [Cu([{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )]) 2 ] + ya sea como su isómero tetraédrico o cuadrado-planar. Los cálculos DFT muestran que la entalpía para la isomerización tetraédrica a cuadrado-planar es positiva para ambos metales, y se favorece la coordinación tetraédrica. Cuando se tiene en cuenta la entropía , se observan pequeños valores positivos para Cu + y valores mayores, pero negativos, para Ag + . Esto significa que la geometría tetraédrica es predominante para Cu + , pero un porcentaje significativo de los complejos adopta una geometría cuadrado-planar en solución. Para Ag + , el equilibrio se desplaza significativamente hacia el lado derecho, lo que presumiblemente explica por qué aún no se ha observado una coordinación tetraédrica de [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] y Ag + .
El examen del empaquetamiento cristalino revela que estos productos son compuestos estratificados que cristalizan en el grupo espacial monoclínico C 2/ c con capas alternadas de aniones [TEF] con carga negativa y capas cargadas positivamente de complejos aislados [M([{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )]) 2 ] + . Las capas se encuentran dentro del plano bc , se alternan a lo largo del eje a y no forman una red bidimensional. [6]
El tratamiento de [{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )] con Tl[TEF] en cloroformo produce un cambio de color inmediato de ámbar a rojo intenso. La estructura cristalina revela una coordinación piramidal trigonal del catión talio , Tl + , mediante tres enlaces P—P coordinados lateralmente de los ligandos P 6 . Dos de estos ligandos P 6 muestran distancias Tl—P más cortas y uniformes de 3,2–3,3 Å con enlaces P—P alargados a unos 2,22 Å, mientras que la tercera unidad muestra una coordinación asimétrica con distancias Tl—P largas de aproximadamente 3,42 y 3,69 Å y sin alargamiento de enlaces P—P.

Aunque el entorno de Tl + es claramente diferente al de Cu + y Ag + , sus estructuras están relacionadas por la red de coordinación bidimensional que se propaga dentro del plano bc . Fundamentalmente, mientras que Cu + y Ag + forman estructuras en capas con cationes complejos [M([{(η 5 - Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 )]) 2 ] + aislados, existe una distribución estadística de los cationes Tl + dentro de la coordinación bidimensional, que muestra una mayor interconexión de los ligandos P 6 para formar una red 2D extendida que podría considerarse como un análogo supramolecular del grafeno . [6]

A pesar de que el complejo sándwich de tres pisos {(η 5 -Me 5 C 5 )Mo} 2 (μ,η 6 -P 6 ) contiene un anillo P 6 demostrablemente planar con longitudes de enlace P—P iguales, los cálculos teóricos revelan que hay al menos 7 isómeros P 6 no planares más bajos en energía que la estructura D 6h planar similar al benceno . [1] [2] [15] [16] [17] [18] [19] [ 20] [21 ] [22] [23] [24] En orden creciente de energía estos son: benzvaleno, prismano, silla, benceno Dewar, biciclopropenilo, benceno distorsionado y benceno. [24]

Un efecto pseudo Jahn–Teller (PJT) es responsable de la distorsión de la estructura similar al benceno D 6h en la estructura D 2 , [25] [26] [27] [28] [29] [30] que ocurre a lo largo del modo doblemente degenerado e 2u como resultado del acoplamiento vibrónico del HOMO − 1 (e 2g ) y LUMO (e 2u ): e 2g ⊗ e 2u = a 1u ⊕ a 2u ⊕ e 2u . Se calcula que la estructura distorsionada se encuentra solo 2,7 kcal mol −1 por debajo en energía de la estructura D 6h . Si la estructura no complejada se sintetizara con éxito, la aromaticidad de la estructura similar al benceno P 6 no sería suficiente para estabilizar la geometría plana, y el efecto PJT daría como resultado la distorsión del anillo. [31]
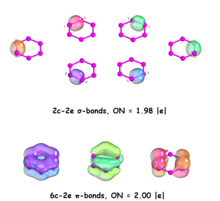
La partición de densidad natural adaptativa (AdNDP) es una herramienta teórica desarrollada por Alexander Boldyrev que se basa en el concepto del par de electrones como elemento principal de los modelos de enlace químico. Por lo tanto, puede recuperar elementos de enlace de Lewis como electrones centrales 1c-2e y pares solitarios, objetos 2c-2e que son enlaces de dos centros y dos electrones, así como elementos de enlace deslocalizados de muchos centros con respecto a la aromaticidad.
El análisis AdNDP de las siete estructuras representativas de P 6 de baja altitud revela que están bien descritas por el modelo clásico de Lewis . Se encuentran un par solitario en cada átomo de fósforo, un enlace σ de dos centros y dos electrones (2c–2e) en cada par de átomos de P adyacentes y un enlace π 2c–2e adicional entre átomos de P adyacentes con coordinación 2, con números de ocupación (ON) de todos estos elementos de enlace superiores a 1,92 |e|. [31]
El enlace químico en la estructura de silla es inusual. Con base en el análisis de orbitales de fragmentos , se concluyó que dos enlaces entre los dos fragmentos P 3 son del tipo hemienlace de un electrón. El análisis AdNDP revela un par solitario en cada átomo de P y seis enlaces σ 2c–2e P—P. Se reveló un enlace π 3c–2e en cada triángulo P 3 con la forma dirigida por el usuario del análisis AdNDP, así como un enlace 4c–2e responsable del enlace entre los dos triángulos P 3 , lo que confirma que este isómero no puede representarse mediante una única estructura de Lewis , y requiere una resonancia de dos estructuras de Lewis , o puede describirse mediante una única fórmula con elementos de enlace deslocalizados .
Tanto la estructura similar al benceno D 6h como el isómero D 2 de P 6 son similares al patrón de enlace AdNDP informado de la molécula de benceno C 6 H 6 : [32] enlace σ 2c–2e y pares solitarios , así como enlaces π 6c-2e deslocalizados . Por lo tanto, la distorsión debida al efecto PJT no altera significativamente el patrón de enlace. [31]


La estructura hexagonal plana P 6 D 6h es un punto de silla de segundo orden debido al efecto pseudo-Jahn–Teller (PJT) , que conduce a la estructura distorsionada D 2. Tras la formación del complejo sándwich , el efecto PJT se suprime debido al llenado de los orbitales moleculares desocupados involucrados en el acoplamiento vibrónico en P 6 con pares de electrones de átomos de Mo. [33] [34] [35] Específicamente, a partir del análisis de orbitales moleculares se determinó que, tras la formación del complejo, el LUMO en la estructura aislada P 6 ahora está ocupado en el complejo de tres pisos como resultado del apreciable mecanismo de retrodonación M → L de tipo δ desde los orbitales atómicos ocupados d x 2 –y 2 y d xy del átomo de Mo hacia los orbitales moleculares π parcialmente antienlazantes de P 6 , restaurando así la alta simetría y planaridad de P 6. [35]