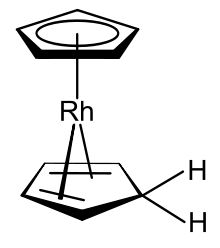
El rodoceno es un compuesto químico con la fórmula [Rh(C 5 H 5 ) 2 ] . Cada molécula contiene un átomo de rodio unido entre dos sistemas aromáticos planos de cinco átomos de carbono conocidos como anillos de ciclopentadienilo en una disposición tipo sándwich . Es un compuesto organometálico ya que tiene enlaces covalentes rodio-carbono ( hápticos ) . [2] El radical [Rh(C 5 H 5 ) 2 ] se encuentra por encima de los 150 °C (302 °F) o cuando se atrapa por enfriamiento a temperaturas de nitrógeno líquido (−196 °C [−321 °F]). A temperatura ambiente, los pares de estos radicales se unen a través de sus anillos de ciclopentadienilo para formar un dímero , un sólido amarillo. [1] [3] [4]
La historia de la química organometálica incluye los descubrimientos del siglo XIX de la sal de Zeise [5] [6] [7] y el tetracarbonilo de níquel . [2] Estos compuestos plantearon un desafío a los químicos ya que no encajaban con los modelos de enlace químico existentes . Un desafío adicional surgió con el descubrimiento del ferroceno , [8] el análogo de hierro del rodoceno y el primero de la clase de compuestos ahora conocidos como metalocenos . [9] Se descubrió que el ferroceno era inusualmente estable químicamente , [10] al igual que las estructuras químicas análogas, incluido el rodocenio, el catión unipositivo del rodoceno [Nota 1] y sus contrapartes de cobalto e iridio . [11] El estudio de las especies organometálicas, incluidas estas, en última instancia condujo al desarrollo de nuevos modelos de enlace que explicaron su formación y estabilidad. [12] [13] El trabajo sobre compuestos sándwich, incluido el sistema rodocenio-rodoceno, le valió a Geoffrey Wilkinson y Ernst Otto Fischer el Premio Nobel de Química de 1973. [14] [15]
Debido a su estabilidad y relativa facilidad de preparación, las sales de rodocenio son el material de partida habitual para preparar rodoceno y rodocenos sustituidos, todos los cuales son inestables. La síntesis original utilizó un anión ciclopentadienilo y tris(acetilacetonato)rodio(III) ; [11] desde entonces se han informado numerosos otros enfoques, incluida la transmetalación redox en fase gaseosa [16] y el uso de precursores de medio sándwich . [17] El octafenilrodoceno (un derivado con ocho grupos fenilo unidos) fue el primer rodoceno sustituido que se aisló a temperatura ambiente, aunque se descompone rápidamente en el aire. La cristalografía de rayos X confirmó que el octafenilrodoceno tiene una estructura de sándwich con una conformación escalonada . [18] A diferencia del cobaltoceno, que se ha convertido en un agente reductor de un electrón útil en la investigación, [19] ningún derivado del rodoceno descubierto hasta ahora es lo suficientemente estable para tales aplicaciones.
Los investigadores biomédicos han examinado las aplicaciones de los compuestos de rodio y sus derivados en medicina [20] y han informado de una posible aplicación de un derivado del rodoceno como radiofármaco para tratar pequeños cánceres . [21] [22] Los derivados del rodoceno se utilizan para sintetizar metalocenos enlazados de modo que se puedan estudiar las interacciones metal-metal; [23] Las posibles aplicaciones de estos derivados incluyen la electrónica molecular y la investigación de los mecanismos de catálisis . [24]

Los descubrimientos en la química organometálica han llevado a importantes conocimientos sobre el enlace químico . La sal de Zeise , K[PtCl 3 (C 2 H 4 )]·H 2 O , se informó en 1831 [5] y el descubrimiento de Mond del tetracarbonilo de níquel ( Ni(CO) 4 ) ocurrió en 1888. [27] Cada uno contenía un enlace entre un centro metálico y una molécula pequeña, etileno en el caso de la sal de Zeise y monóxido de carbono en el caso del tetracarbonilo de níquel. [6] El modelo de relleno de espacio del anión de la sal de Zeise (imagen a la izquierda) [25] [26] muestra un enlace directo entre el centro metálico de platino (mostrado en azul) y los átomos de carbono (mostrados en negro) del ligando de etileno ; tales enlaces metal-carbono son la característica definitoria de las especies organometálicas . Los modelos de enlace no pudieron explicar la naturaleza de dichos enlaces metal-alqueno hasta que se propuso el modelo Dewar-Chatt-Duncanson en la década de 1950. [12] [7] [28] La formulación original solo cubría los enlaces metal-alqueno [27] pero el modelo se expandió con el tiempo para cubrir sistemas como los carbonilos metálicos (incluido [Ni(CO) 4 ] ) donde el enlace π es importante. [28]
El ferroceno , [Fe(C 5 H 5 ) 2 ] , se sintetizó por primera vez en 1951 durante un intento de preparar el fulvaleno ( C
10yo
8) por dimerización oxidativa de ciclopentadieno ; se encontró que el producto resultante tenía la fórmula molecular C
10yo
10Fe y se informó que exhibe "estabilidad notable". [10] El descubrimiento despertó un interés sustancial en el campo de la química organometálica, [8] [9] en parte porque la estructura propuesta por Pauson y Kealy era inconsistente con los modelos de enlace existentes en ese momento y no explicaba su inesperada estabilidad. En consecuencia, el desafío inicial fue determinar definitivamente la estructura del ferroceno con la esperanza de que entonces se entendieran su enlace y propiedades. La estructura sándwich fue deducida e informada de forma independiente por tres grupos en 1952: Robert Burns Woodward y Geoffrey Wilkinson investigaron la reactividad para determinar la estructura [29] y demostraron que el ferroceno experimenta reacciones similares a una molécula aromática típica (como el benceno ), [30] Ernst Otto Fischer dedujo la estructura sándwich y también comenzó a sintetizar otros metalocenos , incluido el cobaltoceno ; [31] Eiland y Pepinsky proporcionaron una confirmación cristalográfica de rayos X de la estructura sándwich. [32] Aplicación de la teoría del enlace de valencia al ferroceno considerando un Fe2+
El centro y dos aniones ciclopentadienuro (C 5 H 5 − ), que se sabe que son aromáticos según la regla de Hückel y, por lo tanto, muy estables, permitieron predecir correctamente la geometría de la molécula. Una vez que se aplicó con éxito la teoría de orbitales moleculares , quedaron claras las razones de la notable estabilidad del ferroceno. [13]
Las propiedades del cobaltoceno descritas por Wilkinson y Fischer demostraron que el catión cobalticinio unipositivo [Co(C 5 H 5 ) 2 ] + exhibía una estabilidad similar a la del propio ferroceno. Esta observación no es inesperada dado que el catión cobalticinio y el ferroceno son isoelectrónicos , aunque el enlace no se comprendía en ese momento. Sin embargo, la observación llevó a Wilkinson y F. Albert Cotton a intentar la síntesis de sales de rodocenio [Nota 1] e iridocenio . [11] Informaron de la síntesis de numerosas sales de rodocenio, incluidas las que contienen los aniones tribromuro ( [Rh(C 5 H 5 ) 2 ]Br 3 ), perclorato ( [Rh(C 5 H 5 ) 2 ]ClO 4 ) y reineckato ( [Rh(C 5 H 5 ) 2 ] [Cr(NCS) 4 (NH 3 ) 2 ]·H 2 O ), y encontraron que la adición de dipicrilamina producía un compuesto de composición [Rh(C 5 H 5 ) 2 ] [N(C 6 H 2 N 3 O 6 ) 2 ] . [11] En cada caso, se encontró que el catión rodocenio poseía una alta estabilidad. Wilkinson y Fischer compartieron el Premio Nobel de Química de 1973 "por su trabajo pionero, realizado de forma independiente, sobre la química de los compuestos organometálicos, llamados compuestos sándwich ". [14] [15]
La estabilidad de los metalocenos se puede comparar directamente observando los potenciales de reducción de la reducción de un electrón del catión unipositivo. Los siguientes datos se presentan en relación con el electrodo de calomelanos saturado (SCE) en acetonitrilo :
Estos datos indican claramente la estabilidad del ferroceno neutro y de los cationes cobaltocenio y rodocenio. El rodoceno es aproximadamente 500 mV más reductor que el cobaltoceno, lo que indica que se oxida más fácilmente y, por lo tanto, es menos estable. [1] Una investigación polarográfica anterior del perclorato de rodocenio a pH neutro mostró un pico de onda catódica a −1,53 V (frente a SCE) en el electrodo de mercurio que gotea , correspondiente a la formación de rodoceno en solución, pero los investigadores no pudieron aislar el producto neutro de la solución. En el mismo estudio, los intentos de detectar iridoceno exponiendo las sales de iridocenio a condiciones oxidantes no tuvieron éxito incluso a pH elevado. Estos datos son consistentes con la alta inestabilidad del rodoceno y pueden indicar que el iridoceno es aún más inestable. [11]
La regla de los 18 electrones es el equivalente de la regla del octeto en la química de los grupos principales y proporciona una guía útil para predecir la estabilidad de los compuestos organometálicos . [34] Predice que las especies organometálicas "en las que la suma de los electrones de valencia del metal más los electrones donados por los grupos ligando suman 18 es probable que sean estables". [34] Esto ayuda a explicar la estabilidad inusualmente alta observada para el ferroceno [10] y para los cationes cobalticinio y rodocenio [31] : las tres especies tienen geometrías análogas y son estructuras isoelectrónicas de 18 electrones de valencia. La inestabilidad del rodoceno y el cobaltoceno también es comprensible en términos de la regla de los 18 electrones, ya que ambos son estructuras de 19 electrones de valencia; esto explica las dificultades tempranas para aislar el rodoceno de las soluciones de rodocenio. [11] La química del rodoceno está dominada por el impulso de alcanzar una configuración de 18 electrones. [34]
El rodoceno existe como [Rh(C 5 H 5 ) 2 ] , un radical monómero paramagnético de 19 electrones de valencia solo a −196 °C (−320,8 °F) ( temperaturas del nitrógeno líquido ) o por encima de 150 °C (302 °F) en la fase gaseosa . [1] [3] [4] Es esta forma monomérica la que muestra la estructura típica de sándwich de metaloceno escalonado . A temperatura ambiente (25 °C [77 °F]), la vida útil de la forma monomérica en acetonitrilo es inferior a dos segundos; [1] y el rodoceno forma [Rh(C 5 H 5 ) 2 ] 2 , una estructura de ansa -metaloceno dimérica con puente de 18 electrones de valencia diamagnética . [35] Las mediciones de resonancia de espín electrónico (ESR), resonancia magnética nuclear (NMR) y espectroscopia infrarroja (IR) apuntan a la presencia de un equilibrio que interconvierte las formas monoméricas y diméricas. [4] La evidencia de ESR confirma que el monómero posee un eje de simetría de alto orden (C n , n > 2) con un plano especular (σ) perpendicular a él como elementos de simetría ; esto demuestra experimentalmente que el monómero posee la estructura sándwich típica de un metaloceno [3] [Nota 2] aunque la interpretación de los datos de ESR ha sido cuestionada. [35] La vía de descomposición del monómero también se ha estudiado por espectrometría de masas . [36] La dimerización es un proceso redox ; el dímero es una especie de rodio (I) y el monómero tiene un centro de rodio (II). [Nota 3] El rodio ocupa típicamente los estados de oxidación +I o +III en sus compuestos estables. [37]
Este proceso de dimerización tiene el efecto general de disminuir el recuento de electrones alrededor del centro de rodio de 19 a 18. Esto ocurre porque el acoplamiento oxidativo de los dos ligandos de ciclopentadienilo produce un nuevo ligando con menor hapticidad y que dona menos electrones al centro metálico. El término hapticidad se utiliza para indicar el "número de átomos de carbono (u otros) a través de los cuales [un ligando] se une ( n )" [38] a un centro metálico y se simboliza como η n . Por ejemplo, el ligando de etileno en la sal de Zeise está unido al centro de platino a través de ambos átomos de carbono y, por lo tanto, formalmente tiene la fórmula K[PtCl 3 (η 2 -C 2 H 4 )]·H 2 O . [6] Los ligandos carbonílicos en el tetracarbonilo de níquel están unidos cada uno a través de un solo átomo de carbono y, por lo tanto, se describen como ligandos monohapto, pero las notaciones η 1 se omiten típicamente en las fórmulas. Los ligandos ciclopentadienílicos en muchos compuestos metaloceno y semi-sándwich son ligandos pentahapto, de ahí la fórmula [Rh(η 5 -C 5 H 5 ) 2 ] para el monómero de rodoceno. En el dímero de rodoceno, los ligandos ciclopentadienílicos acoplados son donantes tetrahapto de 4 electrones para cada centro metálico de rodio(I), en contraste con los donantes pentahapto de ciclopentadienilo de 6 electrones [Nota 4] . La mayor estabilidad de la especie de dímero de rodio(I) de 18 electrones de valencia en comparación con el monómero de rodio(II) de 19 electrones de valencia probablemente explica por qué el monómero solo se detecta en condiciones extremas. [1] [4]
Cotton y Wilkinson demostraron [11] que el catión rodio(III) rodocenio de 18 electrones de valencia [Rh(η 5 -C 5 H 5 ) 2 ] + se puede reducir en solución acuosa a la forma monomérica; no pudieron aislar el producto neutro ya que no solo puede dimerizarse, sino que el monómero radical rodio(II) también puede formar espontáneamente la especie rodio(I) estable de hapticidad mixta [(η 5 -C 5 H 5 )Rh(η 4 -C 5 H 6 )] . [3] Las diferencias entre el rodoceno y este derivado se encuentran en dos áreas:
Estos dos cambios hacen que el derivado sea una especie de 18 electrones de valencia. Fischer y sus colegas plantearon la hipótesis de que la formación de este derivado del rodoceno podría ocurrir en pasos separados de protonación y reducción, pero no publicaron ninguna evidencia que apoyara esta sugerencia. [3] El (η 4 -Ciclopentadieno)(η 5 -ciclopentadienil)rodio(I), el compuesto resultante, es un complejo organometálico inusual ya que tiene tanto un anión ciclopentadienilo como el propio ciclopentadieno como ligandos. Se ha demostrado que este compuesto también se puede preparar mediante la reducción con borohidruro de sodio de una solución de rodocenio en etanol acuoso ; los investigadores que hicieron este descubrimiento caracterizaron el producto como hidruro de bisciclopentadienilrodio. [39]
Fischer y sus colaboradores también estudiaron la química del iridoceno, el análogo de la tercera serie de transición del rodoceno y el cobaltoceno, y descubrieron que la química del rodoceno y el iridoceno es generalmente similar. Se ha descrito la síntesis de numerosas sales de iridocenio, incluidos el tribromuro y el hexafluorofosfato . [4] Al igual que con el rodoceno, el iridoceno dimeriza a temperatura ambiente, pero se puede detectar una forma monomérica a bajas temperaturas y en fase gaseosa, y las mediciones de IR, RMN y ESR indican que existe un equilibrio químico y confirman la estructura tipo sándwich del monómero de iridoceno. [3] [4] El complejo [(η 5 -C 5 H 5 )Ir(η 4 -C 5 H 6 )] , el análogo del derivado del rodoceno reportado por Fischer, [3] también ha sido estudiado y demuestra propiedades consistentes con un mayor grado de enlace π en sistemas de iridio(I) que el encontrado en los casos análogos de cobalto(I) o rodio(I). [40]
Las sales de rodocenio se informaron por primera vez [11] dentro de los dos años posteriores al descubrimiento del ferroceno. [10] Estas sales se prepararon haciendo reaccionar el reactivo de Grignard carbanión bromuro de ciclopentadienilmagnesio ( C
5yo
5MgBr ) con tris(acetilacetonato)rodio(III) (Rh(acac) 3 ). Más recientemente, se han generado cationes de rodocenio en fase gaseosa mediante una reacción de transmetalación redox de iones de rodio(I) con ferroceno o niqueloceno . [16]
También se han descrito métodos sintéticos modernos por microondas. [41] El hexafluorofosfato de rodocenio se forma después de la reacción del ciclopentadieno y el hidrato de cloruro de rodio (III) en metanol después del tratamiento con hexafluorofosfato de amonio metanólico ; el rendimiento de la reacción supera el 60% con solo 30 segundos de exposición a la radiación de microondas . [42]
El rodoceno en sí se forma por reducción de sales de rodoceno con sodio fundido . [3] Si una masa fundida que contiene rodoceno se trata con metales de sodio o potasio y luego se sublima sobre un dedo frío enfriado con nitrógeno líquido, se obtiene un material policristalino negro. [35] Calentar este material a temperatura ambiente produce un sólido amarillo que se ha confirmado como el dímero de rodoceno. Se puede utilizar un método similar para preparar el dímero de iridoceno. [35]
Se han desarrollado nuevos enfoques para sintetizar complejos de ciclopentadienilo sustituidos utilizando materiales de partida de vinilciclopropeno sustituido. [43] [44] [45] Las reacciones de reordenamiento de vinilciclopropano con agrandamiento de anillo para producir ciclopentenos son bien conocidas [46] y sirven como precedente para el reordenamiento de vinilciclopropenos a ciclopentadienos. El catión [(η 5 -C 5 t Bu 3 H 2 )Rh(η 5 -C 5 H 5 )] + se ha generado mediante una secuencia de reacción que comienza con la adición del dímero de clorobisetilenrodio(I), [(η 2 -C 2 H 4 ) 2 Rh(μ-Cl)] 2 , a 1,2,3-tri- terc -butil-3-vinil-1-ciclopropeno seguida de una reacción con ciclopentadienuro de talio : [43] [44]
La especie de rodio(III) pentadienediilo con 18 electrones de valencia generada por esta reacción demuestra nuevamente la inestabilidad de la fracción rodoceno, ya que puede refluirse en tolueno durante meses sin que se forme 1,2,3-tri- terc -butilrodoceno, pero en condiciones oxidantes el catión 1,2,3-tri- terc -butilrodocenio se forma rápidamente. [43] La voltamperometría cíclica se ha utilizado para investigar este y otros procesos similares en detalle. [43] [44] Se ha demostrado que el mecanismo de la reacción implica una pérdida de un electrón del ligando pentadienediilo seguida de un reordenamiento rápido (con pérdida de un átomo de hidrógeno) para formar el catión 1,2,3-tri- terc -butilrodocenio. [44] Tanto las sales de tetrafluoroborato como de hexafluorofosfato de este catión se han caracterizado estructuralmente mediante cristalografía de rayos X. [44]
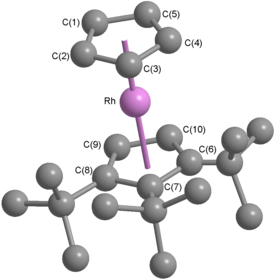
[(η 5 -C 5 t Bu 3 H 2 )Rh(η 5 -C 5 H 5 )]BF 4 forma un cristal monoclínico centrosimétrico incoloro perteneciente al grupo espacial P 2 1 /c , y con una densidad de 1,486 g cm −3 . [44] Observando el diagrama ORTEP de la estructura del catión (a la derecha), es evidente que posee la geometría típica esperada de un catión rodoceno o rodocenio. Los dos anillos de ciclopentadienilo son casi paralelos (el ángulo centroide –Rh–centroide es 177,2°) y el centro de rodio está ligeramente más cerca del anillo de ciclopentadienilo sustituido (las distancias Rh–centroide son 1,819 Å y 1,795 Å), una observación atribuida al mayor efecto inductivo de los grupos terc -butilo sobre el ligando sustituido. [44] El diagrama ORTEP muestra que el catión adopta una conformación eclipsada en estado sólido. La estructura cristalina de la sal de hexafluorofosfato muestra tres cationes cristalográficamente independientes, uno eclipsado, uno escalonado y uno que está desordenado rotacionalmente. [44] Esto sugiere que la conformación adoptada depende del anión presente y también que la barrera de energía a la rotación es baja: en el ferroceno, se sabe que la barrera de energía rotacional es de ~5 kJ mol −1 tanto en solución como en fase gaseosa. [13]

El diagrama anterior muestra las distancias de enlace rodio-carbono ( en rojo, dentro de los pentágonos a la izquierda) y carbono-carbono ( en azul, fuera de los pentágonos a la izquierda) para ambos ligandos, junto con los ángulos de enlace ( en verde, dentro de los pentágonos a la derecha) dentro de cada anillo de ciclopentadienilo. Las etiquetas de átomos utilizadas son las mismas que las que se muestran en la estructura cristalina anterior. Dentro del ligando de ciclopentadienilo no sustituido, las longitudes de enlace carbono-carbono varían entre 1,35 Å y 1,40 Å y los ángulos de enlace internos varían entre 107° y 109°. A modo de comparación, el ángulo interno en cada vértice de un pentágono regular es de 108°. Las longitudes de enlace rodio-carbono varían entre 2,16 Å y 2,18 Å. [44] Estos resultados son consistentes con la coordinación η 5 del ligando con el centro metálico. En el caso del ligando ciclopentadienilo sustituido, hay una variación algo mayor: las longitudes de los enlaces carbono-carbono varían entre 1,39 Å y 1,48 Å, los ángulos de enlace internos varían entre 106° y 111°, y las longitudes de los enlaces rodio-carbono varían entre 2,14 Å y 2,20 Å. La mayor variación en el ligando sustituido se atribuye a las distorsiones necesarias para aliviar la tensión estérica impuesta por los sustituyentes terc -butilo vecinos; a pesar de estas variaciones, los datos demuestran que el ciclopentadienilo sustituido también está η5 - coordinado. [44]
La estabilidad de los metalocenos cambia con la sustitución de anillos. La comparación de los potenciales de reducción de los cationes cobaltocenio y decametilcobaltocenio muestra que la especie decametilo es aproximadamente 600 mV más reductora que su metaloceno original, [19] una situación que también se observa en los sistemas ferroceno [47] y rodoceno. [48] Los siguientes datos se presentan en relación con el par redox ferrocenio / ferroceno : [49]
Las diferencias en los potenciales de reducción se atribuyen en el sistema del cobaltocenio al efecto inductivo de los grupos alquilo, [19] que estabilizan aún más las especies de 18 electrones de valencia. Un efecto similar se observa en los datos del rodocenio que se muestran arriba, nuevamente consistente con los efectos inductivos. [44] En el sistema del iridocenio sustituido, las investigaciones de voltametría cíclica muestran reducciones irreversibles a temperaturas tan bajas como -60 °C; [50] en comparación, la reducción de los rodocenos correspondientes es casi reversible a temperatura ambiente y completamente reversible a -35 °C. [48] La irreversibilidad de las reducciones del iridocenio sustituido se atribuye a la dimerización extremadamente rápida de las especies de 19 electrones de valencia resultantes, lo que ilustra aún más que los iridocenos son menos estables que sus rodocenos correspondientes. [50]
El conjunto de conocimientos sobre los compuestos con ligandos de ciclopentadienilo penta-sustituidos es extenso, y los complejos organometálicos de los ligandos pentametilciclopentadienilo y pentafenilciclopentadienilo son bien conocidos. [51] Las sustituciones en los anillos de ciclopentadienilo de rodocenos y sales de rodocenio producen compuestos de mayor estabilidad, ya que permiten una mayor deslocalización de la carga positiva o densidad electrónica y también proporcionan un impedimento estérico contra otras especies que se aproximan al centro metálico. [36] Se conocen varias especies de rodocenio mono- y disustituidas, pero no se logra una estabilización sustancial sin mayores sustituciones. [36] Las sales de rodocenio altamente sustituidas conocidas incluyen hexafluorofosfato de decametilrodocenio [( η5 - C5Me5 ) 2Rh ]PF6 , [ 52] hexafluorofosfato de decaisopropilrodocenio [(η5 - C5iPr5 ) 2Rh ] PF6 , [ 53] y hexafluorofosfato de octafenilrodocenio [ (η5 - C5Ph4H ) 2Rh ] PF6 . [ 18] [Nota 5] El tetrafluoroborato de decametilrodocenio se puede sintetizar a partir del complejo tris(acetona) [(η5 - C5Me5 ) Rh ( Me2CO ) 3 ] ( BF4 ) 2 mediante reacción con pentametilciclopentadieno , y también se conoce la síntesis análoga de iridio. [54] El hexafluorofosfato de decaisopropilrodicnio se sintetizó en 1,2-dimetoxietano ( disolvente ) en una síntesis inusual en un solo recipiente que implica la formación de 20 enlaces carbono-carbono : [53]
En una reacción similar , el hexafluorofosfato de pentaisopropilrodocenio [(η5-C5iPr5)Rh(η5-C5H5)]PF6 se puede sintetizar a partir del hexafluorofosfato de pentametilrodocenio [(η5- C5Me5 ) Rh ( η5 - C5H5 ) ] PF6 con un rendimiento del 80 % . [ 53 ] Estas reacciones demuestran que la acidez de los hidrógenos de metilo en un complejo de pentametilciclopentadienilo se puede aumentar considerablemente con la presencia del centro metálico. Mecanísticamente, la reacción procede con hidróxido de potasio desprotonando un grupo metilo y el carbanión resultante experimentando una sustitución nucleofílica con yoduro de metilo para formar un nuevo enlace carbono-carbono. [53]
También se han descrito los compuestos tetrafluoroborato de pentafenilrodocenio [(η 5 -C 5 Ph 5 )Rh(η 5 -C 5 H 5 )]BF 4 y tetrafluoroborato de pentametilpentafenilrodocenio [(η 5 -C 5 Ph 5 )Rh(η 5 -C 5 Me 5 )]BF 4 , que demuestran que se pueden preparar compuestos sándwich de rodio a partir de precursores de medio sándwich. Por ejemplo, en un enfoque muy similar a la síntesis de tris(acetona) de tetrafluoroborato de decametilrodocenio, [54] se ha sintetizado tetrafluoroborato de pentafenilrodocenio a partir de la sal de tris( acetonitrilo) [(η5-C5Ph5 ) Rh ( CH3CN ) 3 ] ( BF4 ) 2 mediante reacción con ciclopentadienuro de sodio : [17]

El octafenilrodoceno, [(η 5 -C 5 Ph 4 H) 2 Rh], es el primer derivado del rodoceno que se aisló a temperatura ambiente. Sus cristales de color verde oliva se descomponen rápidamente en solución y en cuestión de minutos en el aire, lo que demuestra una sensibilidad al aire considerablemente mayor que el complejo de cobalto análogo , aunque es significativamente más estable que el propio rodoceno. Esta diferencia se atribuye a la estabilidad relativamente menor del estado de rodio (II) en comparación con el estado de cobalto (II). [18] [37] El potencial de reducción para el catión [(η 5 -C 5 Ph 4 H) 2 Rh] + (medido en dimetilformamida en relación con el par ferrocenio / ferroceno) es de −1,44 V, lo que es coherente con la mayor estabilización termodinámica del rodoceno por el ligando C 5 HPh 4 en comparación con los ligandos C 5 H 5 o C 5 Me 5 . [18] El cobaltoceno es un agente reductor de un electrón útil en el laboratorio de investigación, ya que es soluble en solventes orgánicos no polares , [19] y su par redox se comporta lo suficientemente bien como para que pueda usarse como un estándar interno en voltamperometría cíclica . [55] Ningún rodoceno sustituido preparado hasta ahora ha demostrado suficiente estabilidad para usarse de manera similar.
La síntesis de octafenilrodoceno se realiza en tres pasos, con un reflujo de diglima seguido de un tratamiento con ácido hexafluorofosfórico y luego una reducción de amalgama de sodio en tetrahidrofurano : [18]
La estructura cristalina del octafenilrodoceno muestra una conformación escalonada [18] (similar a la del ferroceno, y en contraste con la conformación eclipsada del rutenoceno ). [13] La distancia rodio-centroide es 1,904 Å y las longitudes de enlace rodio-carbono promedian 2,26 Å; las longitudes de enlace carbono-carbono promedian 1,44 Å. [18] Estas distancias son todas similares a las encontradas en el catión 1,2,3-tri- tert -butilrodocenio descrito anteriormente, con la única diferencia de que el tamaño efectivo del centro de rodio parece mayor, una observación consistente con el radio iónico expandido del rodio(II) en comparación con el rodio(III). [44]
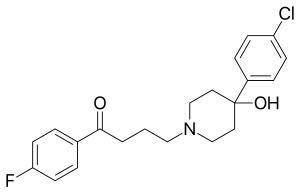
Se han realizado numerosas investigaciones sobre los metalofármacos , [56] [57] incluyendo una discusión sobre los compuestos de rodio en medicina. [20] Un cuerpo sustancial de investigación ha examinado el uso de derivados de metaloceno del rutenio [58] y hierro [59] como metalofármacos. Un área de dicha investigación ha utilizado metalocenos en lugar del grupo fluorofenilo en el haloperidol , [21] que es un fármaco clasificado como un antipsicótico típico . El compuesto ferrocenil-haloperidol investigado tiene la estructura (C 5 H 5 )Fe(C 5 H 4 )–C(=O)–(CH 2 ) 3 –N(CH 2 CH 2 ) 2 C(OH)–C 6 H 4 Cl y se puede convertir al análogo del rutenio a través de una reacción de transmetalación. El uso del isótopo radiactivo 103 Ru produce un radiofármaco rutenocenil-haloperidol con una alta afinidad por el tejido pulmonar pero no cerebral en ratones y ratas . [21] La desintegración beta del 103 Ru produce el isótopo metaestable 103 m Rh en un compuesto de rodoceno-haloperidol. Este compuesto, al igual que otros derivados del rodoceno, tiene una configuración electrónica de valencia 19 inestable y se oxida rápidamente a la especie catiónica esperada de rodocenio-haloperidol. [21] Se ha estudiado la separación de las especies rutenocenil-haloperidol y rodocenio-haloperidol y las distribuciones de cada una entre los órganos corporales. [22] El 103 m Rh tiene una vida media de 56 min y emite un rayo gamma de energía 39,8 keV , por lo que la desintegración gamma del isótopo rodio debería seguir poco después de la desintegración beta del isótopo rutenio. Los radionucleidos emisores de rayos beta y gamma utilizados en medicina incluyen 131 I , 59 Fe y 47 Ca , y se ha propuesto el uso del 103 m Rh en radioterapia para tumores pequeños. [20]
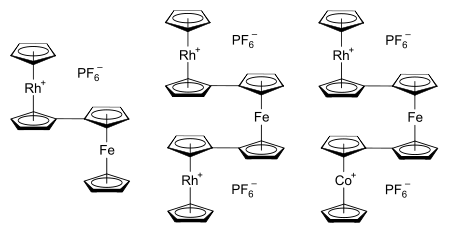
La motivación original para las investigaciones del sistema rodoceno fue comprender la naturaleza y los enlaces dentro de la clase de compuestos metaloceno. En tiempos más recientes, el interés se ha reavivado por el deseo de explorar y aplicar las interacciones metal-metal que ocurren cuando los sistemas metaloceno están vinculados. [23] Las aplicaciones potenciales para tales sistemas incluyen la electrónica molecular , [24] los polímeros metaloceno semiconductores (y posiblemente ferromagnéticos ) (un ejemplo de un cable molecular ), [23] y la exploración del umbral entre catálisis heterogénea y homogénea . [24] Los ejemplos de bimetalocenos y termetalocenos conocidos que poseen la porción rodocenilo incluyen las sales de hexafluorofosfato de rodocenilferroceno, 1,1'-dirhodocenilferroceno y 1-cobaltocenil-1'-rodocenilferroceno, [60] cada uno mostrado a la derecha. Los metalocenos enlazados también pueden formarse introduciendo varios sustituyentes metalocenilo en un solo ligando de ciclopentadienilo. [24]
Los estudios estructurales de los sistemas de termetaloceno han demostrado que suelen adoptar una geometría de "cigüeñal" de "doble transoide eclipsado". [61] Si tomamos como ejemplo el catión 1-cobaltocenil-1'-rodocenilferroceno que se muestra arriba, esto significa que las fracciones cobaltocenilo y rodocenilo están eclipsadas y, por lo tanto, los átomos de carbono 1 y 1' en el núcleo central del ferroceno están tan alineados verticalmente como es posible dada la conformación escalonada de los anillos de ciclopentadienilo dentro de cada unidad de metaloceno. Visto de lado, esto significa que los termetalocenos se asemejan al patrón abajo-arriba-abajo de un cigüeñal . [61] La síntesis de este termetaloceno implica la combinación de soluciones de rodocenio y cobaltocenio con 1,1'-dilitioferroceno . Esto produce un intermedio sin carga con ligandos de ciclopentadienil-ciclopentadieno unidos cuyo enlace se asemeja al encontrado en el dímero de rodoceno. Estos ligandos luego reaccionan con el carbocatión trifenilmetilo para generar la sal de termetaloceno, [(η 5 -C 5 H 5 )Rh(μ-η 5 :η 5 -C 5 H 4 –C 5 H 4 )Fe(μ-η 5 :η 5 -C 5 H 4 –C 5 H 4 )Co(η 5 -C 5 H 5 )](PF 6 ) 2 . Esta vía sintética se ilustra a continuación: [60] [61]
Los primeros polímeros de cadena lateral que contenían rodocenio se prepararon mediante técnicas de polimerización controlada, como la polimerización por transferencia de cadena por adición-fragmentación reversible (RAFT) y la polimerización por metátesis por apertura de anillo (ROMP). [62]
Una aplicación industrial de la química organometálica de metales de transición apareció ya en la década de 1880, cuando Ludwig Mond demostró que el níquel se puede purificar utilizando CO para recoger níquel en forma de Ni(CO) 4 gaseosoque
se
puede separar fácilmente de las impurezas sólidas y luego descomponer térmicamente para dar níquel puro.
... Trabajos recientes han demostrado la existencia de una clase creciente de metaloenzimas que tienen entornos de ligandos organometálicos, considerados como la química de iones metálicos que tienen ligandos donantes de C como CO o el grupo metilo.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )Ambos metales presentan una química extensa, principalmente en el estado de oxidación +3, siendo también importante el +1, y existiendo una química significativa del iridio +4. Se conocen pocos compuestos en el estado +2, en contraste con la situación del cobalto, su homólogo más ligero (los factores responsables incluyen la mayor estabilidad del estado +3 consecuente con la mayor estabilización del espín bajo d 6 a medida que aumenta 10 Dq)." (p. 78)