
El tetracloruro de titanio es un compuesto inorgánico con la fórmula TiCl 4 . Es un intermediario importante en la producción de titanio metálico y del pigmento dióxido de titanio . El TiCl 4 es un líquido volátil . Al entrar en contacto con el aire húmedo, forma nubes espesas de dióxido de titanio ( TiO 2 ) y ácido clorhídrico , una reacción que antiguamente se explotaba para su uso en máquinas de humo. A veces se le denomina "cosquilleo" o "cosquilleo 4", como representación fonética de los símbolos de su fórmula molecular ( TiCl 4 ). [7] [8]
El TiCl 4 es un líquido denso e incoloro, aunque las muestras crudas pueden ser amarillas o incluso de color marrón rojizo. Es uno de los raros haluros de metales de transición que es líquido a temperatura ambiente, siendo otro ejemplo el VCl 4 . Esta propiedad refleja el hecho de que las moléculas de TiCl 4 se autoasocian débilmente. La mayoría de los cloruros metálicos son polímeros , en los que los átomos de cloruro forman puentes entre los metales. Su punto de fusión es similar al del CCl 4 . [9] [10]
El Ti 4+ tiene una capa electrónica "cerrada", con el mismo número de electrones que el gas noble argón . La estructura tetraédrica del TiCl 4 es consistente con su descripción como un centro metálico ad 0 ( Ti 4+ ) rodeado por cuatro ligandos idénticos. Esta configuración conduce a estructuras altamente simétricas , de ahí la forma tetraédrica de la molécula. El TiCl 4 adopta estructuras similares a las del TiBr 4 y el TiI 4 ; los tres compuestos comparten muchas similitudes. El TiCl 4 y el TiBr 4 reaccionan para dar haluros mixtos TiCl 4− x Br x , donde x = 0, 1, 2, 3, 4. Las mediciones de resonancia magnética también indican que el intercambio de haluros también es rápido entre el TiCl 4 y el VCl 4 . [11]
El TiCl 4 es soluble en tolueno y clorocarbonos . Ciertos arenos forman complejos del tipo [(C 6 R 6 )TiCl 3 ] + . [12] El TiCl 4 reacciona exotérmicamente con disolventes donantes como el THF para dar aductos hexacoordinados . [13] Los ligandos más voluminosos (L) dan aductos pentacoordinados TiCl 4 L .
El TiCl 4 se produce mediante el proceso de cloruro , que implica la reducción de minerales de óxido de titanio, típicamente ilmenita ( FeTiO 3 ), con carbono bajo cloro circulante a 900 °C. Las impurezas se eliminan por destilación . [10]
La coproducción de FeCl 3 es indeseable, lo que ha motivado el desarrollo de tecnologías alternativas. En lugar de utilizar directamente la ilmenita, se utiliza "escoria de rutilo". Este material, una forma impura de TiO 2 , se deriva de la ilmenita mediante la eliminación del hierro, ya sea mediante reducción con carbón o extracción con ácido sulfúrico . El TiCl 4 crudo contiene una variedad de otros haluros volátiles, incluido el cloruro de vanadilo ( VOCl 3 ), el tetracloruro de silicio ( SiCl 4 ) y el tetracloruro de estaño ( SnCl 4 ), que deben separarse. [10]
El suministro mundial de titanio metálico, unas 250.000 toneladas al año, se realiza a partir de TiCl4 . La conversión implica la reducción del tetracloruro con magnesio metálico. Este procedimiento se conoce como proceso Kroll : [14]
En el proceso Hunter , el agente reductor es el sodio líquido en lugar del magnesio. [15]
Alrededor del 90% de la producción de TiCl 4 se utiliza para fabricar el pigmento dióxido de titanio ( TiO 2 ). La conversión implica la hidrólisis de TiCl 4 , un proceso que forma cloruro de hidrógeno : [14]
En algunos casos, el TiCl 4 se oxida directamente con oxígeno :
Se ha utilizado para producir cortinas de humo, ya que produce un humo blanco denso que tiene poca tendencia a elevarse. El "tickle" era el método estándar para producir efectos de humo en el plató de películas, antes de dejar de utilizarse en los años 80 debido a las preocupaciones sobre los efectos del HCl hidratado en el sistema respiratorio. [16]
El tetracloruro de titanio es un reactivo versátil que forma diversos derivados, incluidos los que se ilustran a continuación. [17]
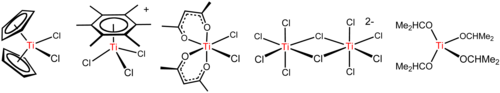
Una reacción característica del TiCl 4 es su fácil hidrólisis , que se manifiesta por la liberación de vapores de HCl y óxidos y oxicloruros de titanio . El tetracloruro de titanio se ha utilizado para crear cortinas de humo navales , ya que el aerosol de ácido clorhídrico y el dióxido de titanio que se forman dispersan la luz de manera muy eficiente. Sin embargo, este humo es corrosivo. [10]
Los alcoholes reaccionan con TiCl 4 para dar alcóxidos con la fórmula [Ti(OR) 4 ] n (R = alquilo , n = 1, 2, 4). Como lo indica su fórmula, estos alcóxidos pueden adoptar estructuras complejas que van desde monómeros a tetrámeros. Dichos compuestos son útiles en la ciencia de los materiales , así como en la síntesis orgánica . Un derivado bien conocido es el isopropóxido de titanio , que es un monómero. El bis(acetilacetonato)dicloruro de titanio resulta del tratamiento del tetracloruro de titanio con un exceso de acetilacetona : [18]
Las aminas orgánicas reaccionan con TiCl 4 para formar complejos que contienen complejos amido ( que contienen R 2 N − ) e imido ( que contienen RN 2− ). Con amoníaco se forma nitruro de titanio . Una reacción ilustrativa es la síntesis de tetrakis(dimetilamido)titanio Ti(N(CH 3 ) 2 ) 4 , un líquido amarillo soluble en benceno: [19] Esta molécula es tetraédrica, con centros de nitrógeno planos. [20]
El TiCl 4 es un ácido de Lewis , como lo implica su tendencia a hidrolizarse . Con el éter THF , el TiCl 4 reacciona para dar cristales amarillos de TiCl 4 (THF) 2 . Con sales de cloruro, el TiCl 4 reacciona para formar secuencialmente [Ti 2 Cl 9 ] − , [Ti 2 Cl 10 ] 2− (ver la figura anterior) y [TiCl 6 ] 2− . [21] La reacción de los iones de cloruro con TiCl 4 depende del contraión. [N(CH 2 CH 2 CH 2 CH 3 ) 4 ]Cl y TiCl 4 dan el complejo pentacoordinado [N(CH 2 CH 2 CH 2 CH 3 ) 4 ][TiCl 5 ] , mientras que un complejo más pequeño, [N(CH 2 CH 3 ) 4 ] +, da [N(CH 2 CH 3 ) 4 ] 2 [Ti 2 Cl 10 ] . Estas reacciones resaltan la influencia de la electrostática en las estructuras de compuestos con enlaces altamente iónicos.
La reducción de TiCl 4 con aluminio da como resultado una reducción de un electrón. El tricloruro ( TiCl 3 ) y el tetracloruro tienen propiedades contrastantes: el tricloruro es un sólido coloreado, al ser un polímero de coordinación , y es paramagnético . Cuando la reducción se lleva a cabo en una solución de THF , el producto Ti(III) se convierte en el aducto azul claro TiCl 3 (THF) 3 .
La química organometálica del titanio comienza típicamente a partir de TiCl 4 . Una reacción importante involucra al ciclopentadienilo sódico para dar dicloruro de titanoceno , TiCl 2 (C 5 H 5 ) 2 . Este compuesto y muchos de sus derivados son precursores de los catalizadores de Ziegler-Natta . El reactivo de Tebbe , útil en química orgánica, es un derivado del titanoceno que contiene aluminio y que surge de la reacción del dicloruro de titanoceno con trimetilaluminio . Se utiliza para las reacciones de "olefinación". [17]
Los arenos , como el C 6 (CH 3 ) 6, reaccionan para formar los complejos de taburete de piano [Ti(C 6 R 6 )Cl 3 ] + (R = H, CH 3 ; véase la figura anterior). Esta reacción ilustra la alta acidez de Lewis del TiCl +3entidad, que se genera por abstracción de cloruro de TiCl 4 por AlCl 3 . [12]
El TiCl 4 se utiliza ocasionalmente en síntesis orgánica , aprovechando su acidez de Lewis , su oxofilia y las propiedades de transferencia de electrones de sus haluros de titanio reducidos. Se utiliza en la adición aldólica catalizada por ácido de Lewis [22]. La clave para esta aplicación es la tendencia del TiCl 4 a activar aldehídos (RCHO) mediante la formación de aductos como (RCHO)TiCl 4 OC(H)R . [23]
Los peligros que presenta el tetracloruro de titanio surgen generalmente de su reacción con el agua, que libera ácido clorhídrico , que es muy corrosivo en sí mismo y cuyos vapores también son extremadamente irritantes. El TiCl 4 es un ácido de Lewis fuerte , que forma aductos exotérmicamente incluso con bases débiles como el THF y el agua.
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) Universidad Estatal de Iowa – “Hojas de datos de seguridad de materiales químicos”{{cite book}}: |journal=ignorado ( ayuda )