Vinílogo
Se encuentran reacciones vinílogas cuando los orbitales π del grupo vinilo y del grupo atractor de electrones están alineados y conjugados, permitiendo al grupo atractor de electrones recibir electrones a través del sistema conjugado.
Esta reactividad se observa en ácidos carboxílicos vinílogos, que tienen un grupo enol seguido y en conjugación con el grupo carbonilo, por ejemplo, en la forma enólica de la acetilacetona.
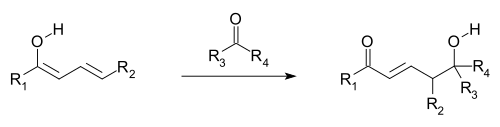
Los nucleófilos alílicos reaccionan frecuentemente por adición nucleofílica viníloga, en vez de por adición directa, esto es denominado transposición alílica.
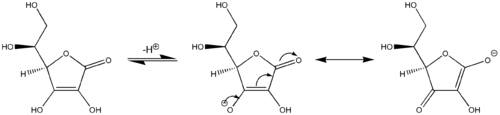
Por ejemplo, el ácido ascórbico (vitamina C) se comporta como un ácido carboxílico vinílogo, con un enlace doble carbonílico, un enlace doble ("vinilo"), y el par libre en el grupo hidroxilo actuando como un sistema conjugado.
[1] Este concepto fue introducido en 1926 por Ludwig Claisen, cuando explicó las propiedades acídicas de la formilacetona y β-cetoaldehídos relacionados.