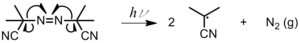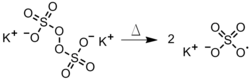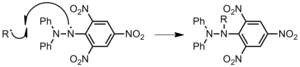Polimerización por radicales libres
La polimerización por radicales libres es el método más antiguo de síntesis polimérica, por este método se sintetizó por primera vez el polietileno y el polipropileno.
La polimerización por radicales libres es una vía de síntesis clave para obtener una amplia variedad de diferentes polímeros y materiales compuestos.
La iniciación por radicales funciona mejor en el enlace doble carbono-carbono de monómeros de vinilo y el enlace carbono-oxígeno doble en aldehídos y cetonas.
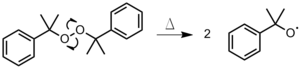
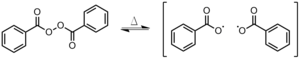
Peroxodisulfatos: La disociación de un Peroxidisulfato en la fase acuosa (Figura 4).
Este método es útil en polimerización en emulsión en la cual se difunden radicales de un monómero hidrófobo contenido en gotitas.
Radiación ionizante: partículas α, partículas β, rayos γ o rayos X provocan la expulsión de un electrón de las especies iniciadoras, seguido por la disociación y captura de electrones para producir un radical (Figura 5).
Electroquímico: Es la electrólisis de una disolución que contiene tanto monómero como electrolito.
Una molécula de monómero recibirá un electrón en el cátodo para convertirse en un anión radical, y una molécula de monómero dará un electrón en el ánodo para formar un catión radical (Figura 6).
Sonicación: Se puede aplicar al monómero una alta intensidad de ultrasonido en las frecuencias más allá del alcance del oído humano (16 kHz).
Esto resulta en la formación de estados electrónicos excitados que a su vez conducen a la rotura del enlace y la formación de radicales libres.
Es decir, sin tacticidad, por esta razón es que este mecanismo no es utilizado para polímeros cuyo control de distribución de pesos moleculares y tacticidad son específicos.
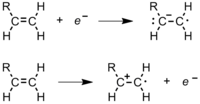
Después de que el iniciador radical se forma, ataca un monómero (Figura 10).
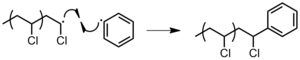
El otro electrón vuelve al segundo átomo de carbono, convirtiendo la molécula completa en otro radical.
En este caso, la polimerización se considera que es una polimerización viva, porque la propagación puede continuar si se añade más monómero a la reacción.
Estas polimerizaciones vivas son más comunes en la polimerización iónica, sin embargo, debido a la alta reactividad de los radicales, la terminación puede ocurrir por varios mecanismos diferentes.
Si se desean cadenas más largas, la concentración de iniciador debe mantenerse baja, y si se desan cadenas cortas, la concentración del iniciador deberá ser mayor.
Sin embargo, a menudo, este radical recién creado no es capaz de propagarse más.
A es el iniciador que se descompone para un compuesto R. M es el monómero.
no cambia, suponiendo que estamos en un estado estacionario (usando la aproximación del estado estacionario), una vez alcanzado el estado estacionario, la cantidad de radicales libres generados será igual a la que reaccionen con el monómero, por lo que vd=vi: La etapa de propagación consiste en la etapa en la que el monómero se adiciona a las distintas cadenas en crecimiento: La velocidad de propagación puede suponerse que no depende de la longitud de las cadenas reactivas (pese al efecto estérico que pueda producir la mayor o menor longitud de las cadenas), sino únicamente de su concentración.
A esta suposición se le conoce como hipótesis de igual reactividad.
La concentración de la cadena activa se puede derivar y se expresa en términos de las otras especies conocidas en el sistema: En este caso, como conocemos
A ese "algo" que pueden encontrarse se le denomina agente de transferencia, A (que puede ser una molécula de disolvente, un iniciador o una impureza del medio): A este proceso se le denomina transferencia de cadena, y produce como resultado una cadena estable y otra molécula activa que puede comenzar un nuevo proceso de propagación.
Definiendo la longitud de la cadena cinética, v, como el número de veces que se repite la polimerización por cada cadena activa.
, se puede correlacionar con la longitud de la cadena cinética.
La ecuación para la longitud de la cadena dinámica se modificará según lo siguiente.
El primer ejemplo de polimerización radicalaria viviente fue reportado por Moad et al.
[16][17] Se usa para sintetizar polímeros lineales o ramificados con distribuciones de peso molecular estrechas y grupos terminales reactivos en cada cadena de polímero.
El proceso también se ha utilizado para crear copolímeros de bloque con propiedades únicas.
Este proceso se usa más comúnmente con acrilatos, estirenos y dienos.
El esquema de reacción en la Figura 22 ilustra el proceso SFRP[18] Debido a que el extremo de la cadena está funcionalizado con la molécula TEMPO (Figura 23), se reduce la terminación prematura por acoplamiento.