NF-κB
NF-kB se encuentra en la mayoría de tipos de células animales y está implicado en la respuesta celular frente a estímulos como el estrés, las citoquinas, radiación ultravioleta, LDL oxidadas y antígenos bacterianos o virales.
La regulación defectuosa del NF-kB está relacionada con el cáncer, enfermedades inflamatorias y autoinmunes, shock séptico, infecciones virales o un desarrollo inmune inadecuado.
[13][14] Los miembros de la familia del NF-κB comparten estructura homóloga con la oncoproteína retroviral v-Rel, lo que da lugar a su clasificación como proteínas NF-κB/Rel.
Esto permite al NF-κB ser la primera respuesta a estímulos celulares nocivos.
Por ejemplo, diversos estudios han identificado TLR4 como un receptor para el componente LPS de las bacterias Gram-Negativas.
[23] Además, los homodímeros p50 y p52 también se unen a la proteína nuclear Bcl-3, pudiendo dichos complejos funcionar como activadores transcripcionales.
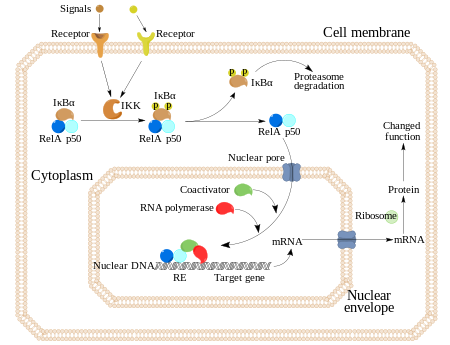
La mitad C-terminal de p100, que a menudo es conocida como IκBδ, también funciona como inhibidor.
Una vez fosforiladas estas serinas (por ejemplo, las serinas 32 y 36 en la IκBα humana), las moléculas del inhibidor IκB son modificadas por un proceso llamado ubiquitinación, que después las lleva a ser degradadas por una estructura celular llamada proteosoma.
Esto provoca que este agente patógeno inhiba eficazmente la vía NF- κB y así bloquea la respuesta inmune de una persona infectada con Yersinia.
Teniendo en cuenta sus diferentes regulaciones, se pensaba que estas dos vías eran independientes una de otra.
Recientemente se ha mostrado un gran interés por el papel de NF-κB en el sistema nervioso.
Debido a ello, muchos tipos diferentes de tumores humanos tienen mal regulados el NF-κB (es decir, activado).
Esto se debe a que NF-κB regula genes anti-apoptóticos (sobre todo la TRAF1 TRAF2) y por tanto, controla la actividad enzimática de las caspasas, que son fundamentales para la mayoría de los procesos apoptóticos.
Por lo tanto, NF-κB es el objeto de muchas empresas farmacéuticas para la terapia contra el cáncer.
[51] Debido a que NF-κB controla varios genes involucrados en la inflamación, no es de extrañar que NF-κB se encuentre activado crónicamente en enfermedades inflamatorias, tales como la enfermedad inflamatoria intestinal, la artritis, sepsis, gastritis, asma y arterosclerosis entre otros.
[52] Es importante señalar que los reguladores clave de la NF-κB se asocian con una elevada mortalidad, especialmente en enfermedades cardiovasculares[53][54] y esquizofrénicas.
[60] Se ha observado que en muchos cánceres hay una sobre activación del factor NF-κB.
Otros medicamentos son el disulfiram, olmesartán y ditiocarbamatos, que inhiben la cascada de señalización del factor nuclear κB (NF-κB).
[65] El Carcinoma Nasofaríngeo (NPC) se caracteriza por células epiteliales tumorales poco diferenciadas que residen en la parte posterior a la faringe.
Es probable que esta característica surja para contrarrestar el entorno inflamatorio debido a la infección persistente por el virus.