Ley de Charles
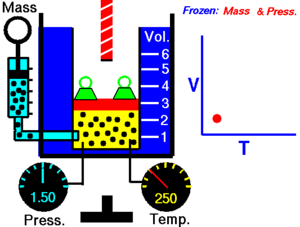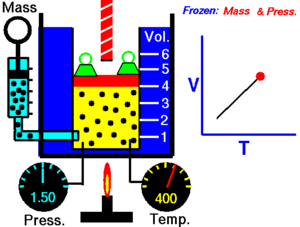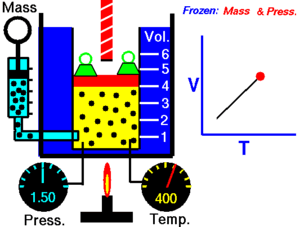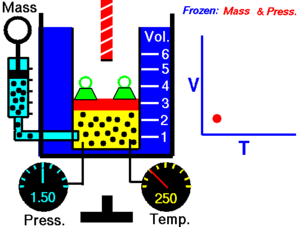
[1]Esta relación de proporción directa se puede escribir como: Entonces esto significa: donde: Esta ley describe cómo se expande un gas a medida que aumenta la temperatura; por el contrario, una disminución de la temperatura conducirá a una disminución del volumen.
Para comparar la misma sustancia bajo dos conjuntos diferentes de condiciones, la ley se puede escribir como:
[2][3] La ley lleva el nombre del físico, químico e inventor francés Jacques Charles, quien formuló la ley original en su obra inédita de la década de 1780.
La ley fue publicada por primera vez por filósofo natural francés Louis Joseph Gay-Lussac en 1802, pero fue descubierta por Jacques Charles ya en 1787.
Los principios básicos ya habían sido descritos por Guillaume Amontons[6] y Francis Hauksbee[7] un siglo antes.
Dalton fue el primero en demostrar que la ley se aplicaba generalmente a todos los gases y a los vapores de líquidos volátiles si la temperatura estaba muy por encima del punto de ebullición.
[8] Con mediciones solo en los dos puntos fijos termométricos del agua, Gay-Lussac no pudo demostrar que la ecuación que relaciona el volumen con la temperatura era una función lineal.
Tanto las principales conclusiones de Dalton como las de Gay-Lussac se pueden expresar matemáticamente como: donde V 100 es el volumen ocupado por una muestra dada de gas a 100 °C; V0 es el volumen ocupado por la misma muestra de gas a 0 °C; y k es una constante que es la misma para todos los gases a presión constante.
Gay-Lussac dio crédito por esta ecuación a declaraciones inéditas de su compatriota J. Charles en 1787.
Las medidas de Dalton tenían mucho más alcance en cuanto a la temperatura que las de Gay-Lussac, midiendo no solo el volumen en los puntos fijos del agua, sino también en dos puntos intermedios.
Gay-Lussac fue claro en su descripción de que la ley no era aplicable a bajas temperaturas:...pero puedo mencionar que esta última conclusión no puede ser verdadera excepto mientras los vapores comprimidos permanezcan enteramente en el estado elástico; y esto requiere que su temperatura sea suficientemente elevada para permitirles resistir la presión que tiende a hacerlos asumir el estado líquido.
Gay-Lussac no tenía experiencia con el aire líquido (preparado por primera vez en 1877), aunque parece haber creído (al igual que Dalton) que los "gases permanentes", como el aire y el hidrógeno, podrían licuarse.
Este hecho está relacionado con un fenómeno que presentan muchos cuerpos cuando pasan del estado líquido al sólido, pero que ya no es sensible a temperaturas algunos grados por encima de aquella a la que se produce la transición.