Isomería
Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.
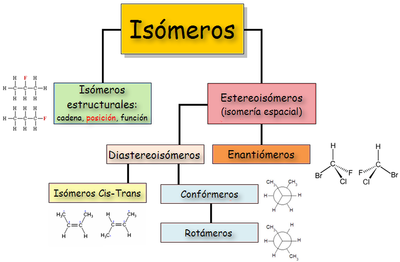
[2] Llegado a este punto, deberán centrar las investigaciones en determinar la manera en la que los átomos están conectados entre sí en la molécula bajo estudio y cómo estos átomos se ordenan en el espacio, momento en el cual entra en juego la isomería, ya que por lo general se abrirán numerosas posibilidades de sustancias con la misma fórmula molecular, todas ellas se conocen por el nombre genérico de isómeros.
[3] Aunque este fenómeno es muy frecuente en química orgánica, no es exclusiva de esta pues también la presentan algunos compuestos inorgánicos.
[5] En 1848, Louis Pasteur separó diminutos cristales de ácido tartárico en sus dos formas especulares.
Debido a esto se pueden presentar tres diferentes modos de isomería: Un ejemplo es el pentano, del cual existen varios isómeros, pero los más conocidos son el isopentano y el neopentano.
Por ejemplo el C4H10 corresponde tanto al butano como al metilpropano (isobutano o terc-butano): Para la fórmula C5H12, tenemos tres posibles isómeros de cadena: pentano, metilbutano (isopentano) y dimetilpropano (neopentano).
Por ejemplo, la fórmula molecular C4H10O puede corresponder a dos sustancias isómeras que se diferencian en la posición del grupo OH: el 1-butanol.
Reciben nombres como sinclinal (a veces, gauche), anticlinal (anti o trans), sinperiplanar y antiperiplanar.
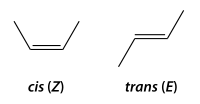
La isometría cis-trans es un tipo de estereoisomería, la cual se refiere a los compuestos que tienen sus átomos conectados en el mismo orden pero tienen diferente orientación tridimensional.
[14] Este tipo de isomería otorga propiedades físicas distintas, debido a que los enlaces dobles no rotan libremente como los simples.
[14] Se produce cuando hay dos carbonos unidos con doble enlace que tienen las otras valencias con los mismos sustituyentes (2 pares) o con dos iguales y uno distinto.
No se presenta isomería geométrica ligada a los enlaces triples o sencillos.
A las dos posibilidades se las denomina: No se pueden interconvertir entre sí estas dos formas de un modo espontáneo, pues el doble enlace impide la rotación, aunque sí pueden convertirse, a veces, en reacciones catalizadas.
Cuando un compuesto tiene al menos un átomo de Carbono asimétrico o quiral, es decir, un átomo de carbono con cuatro sustituyentes diferentes, pueden formarse dos variedades distintas llamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas o formas quirales, aunque todos los átomos están en la misma posición y enlazados de igual manera.
[8] Los isómeros ópticos no se pueden superponer, como ocurre con las manos derecha e izquierda.
Así pues, hay tres sistemas de nombrar estos compuestos: Cuando un compuesto tiene más de un carbono asimétrico, podemos encontrar formas enantiómeras y otras formas que no son exactamente copias especulares, por no tener todos sus carbonos invertidos.
Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre de forma meso.
[20] Hay varios tipos de isomería presente en compuestos inorgánicos, sobre todo en complejos de coordinación,[21] pero este fenómeno no es tan importante como en química orgánica: La isomerización es el proceso mediante el cual una molécula se transforma en otra molécula que tiene exactamente los mismos átomos, pero los átomos se reordenan.