Electrólisis
Así, los procesos que suceden en celdas galvánicas y electrolíticas son inversos entre sí.
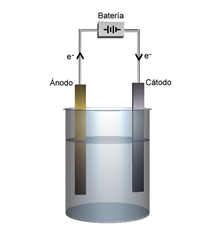
El proceso de usar una corriente eléctrica para producir un cambio se conoce como electrólisis.
A principios del siglo XIX, William Nicholson y Anthony Carlisle intentaron profundizar en los experimentos de Volta.
[2] En 1785 un científico neerlandés llamado Martin van Marum creó un generador electrostático que utilizó para reducir estaño, zinc y antimonio a partir de sus sales mediante un proceso conocido posteriormente como electrólisis.
Afirmó que colocando músculo animal entre dos láminas metálicas disímiles se producía electricidad.
[6] En 1817 Johan August Arfwedson determinó que había otro elemento, el litio, en algunas de sus muestras; sin embargo, no pudo aislar el componente.
No fue hasta 1821 cuando William Thomas Brande utilizó la electrólisis para individualizarlo.
En diciembre siguiente, presentó su descubrimiento del galio a la Académie des sciences de París.
[12] En 1886 Charles Martin Hall de Estados Unidos y Paul Héroult de Francia solicitaron patentes estadounidenses para la electrólisis del aluminio, Héroult presentó la suya en mayo y Hall, en julio.
[13] Hall pudo conseguir su patente demostrando mediante cartas a su hermano y pruebas familiares que su método había sido descubierto antes de que se presentara la patente francesa.
Por consiguiente, la batería debe suministrar un mínimo de 4 V para que la reacción se lleve a cabo.
En la práctica, sin embargo, se necesita un voltaje mayor debido a la ineficiencia del proceso electrolítico y al sobrevoltaje.
Una disolución acuosa saturada de cloruro de sodio (salmuera) entra al compartimento anódico, donde el Cl- se oxida a Cl2 gaseoso, y entra agua al compartimento del cátodo, donde se convierte en H2 gaseoso y iones OH-.
La membrana mantiene separados al Cl2 y a los iones OH-, aunque permite el paso de una corriente de iones Na+ hacia el compartimento del cátodo, conduciendo así la corriente en la disolución y manteniendo la neutralidad eléctrica en ambos compartimentos.