Tampón químico
Se puede entender esta propiedad como consecuencia del efecto ion común y las diferentes constantes de acidez o basicidad: una pequeña cantidad de ácido o base desplaza levemente el equilibrio ácido-base débil, lo cual tiene una consecuencia menor sobre el pH.
Debido al efecto disociante del agua, en la disolución resultante tendremos:
De manera similar ocurre si se agrega una base fuerte a la mezcla.
En este caso, parte de los iones de hidrógeno son neutralizados, disminuyendo su concentración, lo que fuerza a que el equilibrio se desplace hacia la derecha.
Otra característica importante es que el pH resultante al preparar la disolución reguladora será igual al pKa del ácido, si la concentración de éste es igual a la de su base conjugada.
Por tratarse de una relación logarítmica de concentraciones, tiene que variar mucho la relación entre el numerador y el denominador para que la variación del pH sea muy significativa.
Si sobre esta disolución se añadiera 0,1 moles de hidróxido sódico, que es una base fuerte, esta reaccionaría con el ácido acético, neutralizando la parte equivalente y formando igual cantidad de acetato sódico que se sumaría al ya existente en la disolución.
Sustituyendo en la ecuación de Henderson-Hasselbalch y sin considerar la dilución, ya que como se ha comentado, no tiene gran efecto, el nuevo pH sería de 4.85, ligeramente superior al pH original (aprox.
Así, por ejemplo, en el caso del ácido carbónico, cuyo efecto regulador es de gran importancia en los seres vivos, se pueden dar dos posibles equilibrios de disociación:
Puesto que por cada equilibrio hay una constante de acidez (o pKa), para el cálculo del pH es necesario considerar cada par conjugado por separado, pues hay dos sistemas conjugados; H2CO3/HCO3- y HCO3-/CO32- y por consiguiente, dos zonas de tamponamiento, una en el entorno de pH = pKa1 y la otra para pH = pKa2 .
En los casos en que esta situación no se da, como por ejemplo en las disoluciones de ácido glutárico, cuyos pKa son 4,3 y 5,4, respectivamente, el cálculo preciso del pH es algo más complejo, pues es necesario considerar los dos equilibrios de disociación de forma simultánea.
Esta consideración es extensible a cualquier sistema poliprótico, como sería el caso del ácido fosfórico (H3PO4 ), con tres pKa: pKa1 = 2,15, pKa2 = 7,20 y pKa3 = 12,15.
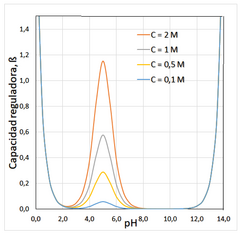
La capacidad tamponadora (también capacidad amortiguadora o capacidad reguladora) de las disoluciones tampón, se define como la relación diferencial entre la cantidad de ácido o base fuerte añadida a la disolución y la variación del pH producida, es decir la diferencia entre el pH inicial y el resultante tras la adición.
En la naturaleza, existen muchos sistemas que utilizan estos tampones para regular el pH.
Muchas biomoléculas actúan a un determinado valor de pH y sólo toleran fluctuaciones mínimas en él.
Por esta razón los líquidos fisiológicos contienen tampones que, a diferencia del agua, mantienen el pH constante.
En realidad, este tampón está compuesto por dos equilibrios, pues el ácido carbónico forma CO2, generando una molécula de H2O.
La suma de las formas sal y ácido se llama reserva alcalina.
En condiciones normales, esta suma tiene el valor 25,2 mEq de CO2 por litro.
Este tampón tiene un pKa de 6,8, el cual está mucho más cerca del pH plasmático.
Así, se trata de un sistema eficaz para amortiguar ácidos.
Como hemos dicho, a nivel sanguíneo, el tampón bicarbonato resulta más útil que el tampón fosfato ya que este último se encuentra en concentraciones bajas.
La captación de O2 se ve afectada, entre otros factores, por los H+ y el CO2.
Así, en los capilares periféricos, dónde encontramos CO2, la hemoglobina cede las moléculas de O2.
En este punto, la variación de pH, si adicionamos NaOH a la disolución, es mínima.
Así, vemos como esta capacidad para captar y ceder protones convierte a las proteínas y aminoácidos en amortiguadores del pH, actuando como ácidos si están protonados, o como bases, si no lo están.
Muchas proteínas tienen grupos protonables en la cadena radical variable, así cada proteína o aminoácido tiene su punto isoeléctrico y su pKa característico para cada grupo protonable del radical variable.
Cuando los aminoácidos se unen formando péptidos mediante enlaces entre el grupo COOH de un aminoácido y el grupo NH2 de otro, desaparecen sus propiedades amortiguadoras.
Ahora bien, siempre existen los grupos terminales y también los grupos ionizables de las cadenas laterales de los aminoácidos: ácido aspártico y glutámico, arginina, lisina, histidina, etc.
Como hemos visto las disoluciones tampón son muy útiles para el mantenimiento del pH en sistemas biológicos, como por ejemplo el cuerpo humano, pero sus propiedades van mucho más lejos y son ampliamente usadas en las industrias actuales.