La memoria inmunológica es la capacidad del sistema inmunológico para reconocer rápida y específicamente un antígeno que el cuerpo ha encontrado previamente e iniciar la respuesta inmune correspondiente . Generalmente son respuestas inmunes secundarias, terciarias y otras posteriores al mismo antígeno. El sistema inmunológico adaptativo y la generación de receptores específicos de antígeno ( TCR , anticuerpos ) son responsables de la memoria inmunológica adaptativa. [ cita necesaria ]
Después de la respuesta inmune inflamatoria al antígeno asociado al peligro, algunas de las células T y células B específicas del antígeno persisten en el cuerpo y se convierten en células T y B de memoria de larga vida . Después del segundo encuentro con el mismo antígeno, lo reconocen y generan una respuesta más rápida y sólida. La memoria inmunológica es la base de la vacunación . [1] [2] Los recursos emergentes muestran que incluso el sistema inmunológico innato puede iniciar una respuesta inmune y una eliminación de patógenos más eficientes después de la estimulación previa con un patógeno, respectivamente con PAMP o DAMP . La memoria inmune innata (también llamada inmunidad entrenada ) no es específica de un antígeno ni depende de la reordenación genética , pero la respuesta diferente es causada por cambios en la programación epigenética y cambios en el metabolismo celular . La memoria inmune innata se observó tanto en invertebrados como en vertebrados . [3] [4]
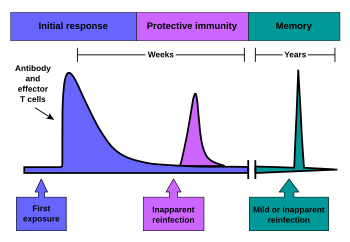
La memoria inmunológica se produce después de una respuesta inmune primaria contra el antígeno. La memoria inmunológica es así creada por cada individuo, tras una exposición inicial previa, a un agente potencialmente peligroso. El curso de la respuesta inmune secundaria es similar a la respuesta inmune primaria. Después de que la célula B de memoria reconoce el antígeno, presenta el complejo péptido: MHC II a las células T efectoras cercanas. Eso conduce a la activación de estas células y a una rápida proliferación de las células. Una vez que la respuesta inmune primaria ha desaparecido, se eliminan las células efectoras de la respuesta inmune. [5]
Sin embargo, los anticuerpos que se crearon previamente en el cuerpo permanecen y representan el componente humoral de la memoria inmunológica y constituyen un importante mecanismo defensivo en infecciones posteriores. Además de los anticuerpos formados, en el cuerpo queda una pequeña cantidad de células T y B de memoria que constituyen el componente celular de la memoria inmunológica. Permanecen en la circulación sanguínea en estado de reposo y en el posterior encuentro con el mismo antígeno estas células son capaces de responder inmediatamente y eliminar el antígeno. Las células de memoria tienen una larga vida y duran hasta varias décadas en el cuerpo. [6] [2]
La inmunidad a la varicela, el sarampión y algunas otras enfermedades dura toda la vida. La inmunidad a muchas enfermedades acaba desapareciendo. La respuesta del sistema inmunológico a algunas enfermedades, como el dengue , empeora de forma contraproducente la siguiente infección ( mejora dependiente de anticuerpos ). [7]
En 2019, los investigadores todavía están tratando de descubrir por qué algunas vacunas producen inmunidad de por vida, mientras que la eficacia de otras vacunas cae a cero en menos de 30 años (para las paperas) o menos de seis meses (para la influenza H3N2 ). [8]
La invención evolutiva de las células T y B de memoria está muy extendida; sin embargo, las condiciones requeridas para desarrollar esta costosa adaptación son específicas. Primero, para desarrollar la memoria inmune el costo inicial de la maquinaria molecular debe ser alto y exigirá pérdidas en otras características del huésped. En segundo lugar, los organismos de vida media o larga tienen mayores posibilidades de desarrollar dicho aparato. El costo de esta adaptación aumenta si el huésped tiene una esperanza de vida mediana, ya que la memoria inmune debe ser efectiva a una edad más temprana. [9]
Además, los modelos de investigación muestran que el medio ambiente desempeña un papel esencial en la diversidad de las células de memoria de una población. La comparación de la influencia de múltiples infecciones con una enfermedad específica en comparación con la diversidad de enfermedades de un entorno proporciona evidencia de que los grupos de células de memoria acumulan diversidad en función del número de patógenos individuales expuestos, incluso a costa de la eficiencia cuando se encuentran patógenos más comunes. Las personas que viven en entornos aislados, como islas, tienen una población menos diversa de células de memoria, que, sin embargo, presentan respuestas inmunitarias más sólidas. Eso indica que el medio ambiente juega un papel importante en la evolución de las poblaciones de células de memoria. [10]
La memoria inmune previamente adquirida puede verse agotada por el sarampión en niños no vacunados, dejándolos en riesgo de infección por otros patógenos en los años posteriores a la infección. [11]
Las células B de memoria son células plasmáticas que pueden producir anticuerpos durante mucho tiempo. A diferencia de las células B vírgenes involucradas en la respuesta inmune primaria , la respuesta de las células B de memoria es ligeramente diferente. La célula B de memoria ya ha experimentado expansión clonal , diferenciación y maduración de afinidad , por lo que es capaz de dividirse varias veces más rápido y producir anticuerpos con mucha mayor afinidad (especialmente IgG ). [1]
Por el contrario, las células plasmáticas vírgenes están completamente diferenciadas y el antígeno no puede estimularlas más para dividirse o aumentar la producción de anticuerpos. La actividad de las células B de memoria en los órganos linfáticos secundarios es máxima durante las primeras 2 semanas después de la infección . Posteriormente, al cabo de 2 a 4 semanas su respuesta decae. Después de la reacción del centro germinal, las células plasmáticas de memoria se ubican en la médula ósea , que es el sitio principal de producción de anticuerpos dentro de la memoria inmunológica. [12]
Las células T de memoria pueden ser tanto CD4+ como CD8+ . Estas células T de memoria no requieren estimulación antigénica adicional para proliferar ; por lo tanto, no necesitan señal vía MHC. [13] Las células T de memoria se pueden dividir en dos grupos funcionalmente distintos según la expresión del receptor de quimiocina CCR7 . Esta quimiocina indica la dirección de migración hacia los órganos linfáticos secundarios . Aquellas células T de memoria que no expresan CCR7 (éstas son CCR7-) tienen receptores para migrar al sitio de inflamación en el tejido y representan una población de células efectoras inmediatas. Estas células fueron denominadas células T efectoras de la memoria ( TEM ). Después de una estimulación repetida, producen grandes cantidades de IFN-γ , IL-4 e IL-5 . Por el contrario, las células T de memoria CCR7+ carecen de función proinflamatoria y citotóxica pero tienen receptores para la migración de los ganglios linfáticos . Estas células se denominaron células T de memoria central (T CM ). Estimulan eficazmente las células dendríticas y, después de una estimulación repetida, pueden diferenciarse en células T de memoria efectoras CCR7. Ambas poblaciones de estas células de memoria se originan a partir de células T vírgenes y permanecen en el cuerpo durante varios años después de la inmunización inicial . [14]
Las técnicas experimentales utilizadas para estudiar estas células incluyen medir la proliferación celular estimulada por antígenos y la liberación de citocinas, teñir con multímeros de péptido-MHC o utilizar un ensayo de marcador inducido por activación (AIM). [15]
Se ha observado que muchos invertebrados , como especies de caracoles de agua dulce , crustáceos copépodos y tenias, activan la memoria inmune innata para instigar una respuesta inmune más eficiente ante un segundo encuentro con patógenos específicos, a pesar de carecer de una rama adaptativa del sistema inmunológico. [3] Los ratones con deficiencia de RAG1 sin células T y B funcionales pudieron sobrevivir a la administración de una dosis letal de Candida albicans cuando se expusieron previamente a una cantidad mucho menor, lo que demuestra que los vertebrados también conservan esta capacidad. [4] A pesar de no tener la capacidad de fabricar anticuerpos como el sistema inmunológico adaptativo , el sistema inmunológico innato también tiene propiedades de memoria inmune. La memoria inmune innata (inmunidad entrenada) se define como una reprogramación funcional a largo plazo de células inmunes innatas provocadas por agresiones exógenas o endógenas y que conducen a una respuesta alterada hacia un segundo desafío después de regresar a un estado no activado. [dieciséis]
Cuando las células inmunes innatas reciben una señal de activación; por ejemplo, mediante el reconocimiento de PAMP con PRR , inician la expresión de genes proinflamatorios, inician una respuesta inflamatoria y se someten a reprogramación epigenética. Después de la segunda estimulación, la activación de la transcripción es más rápida y robusta. [17] Se informó memoria inmunológica en monocitos , macrófagos , células NK , ILC1 , ILC2 y recientemente también en ILC3 , [18] [17] Concomitantemente, algunas células no inmunes, por ejemplo, células madre epiteliales en tejidos de barrera o fibroblastos. , cambian su estado epigenético y responden de manera diferente después del insulto cebado. [19]
En el estado estacionario, las células no estimuladas tienen actividades biosintéticas reducidas y cromatina más condensada con transcripción genética reducida. La interacción de PAMP exógenos ( β-glucano , péptido muramil ) o DAMP endógenos ( LDL oxidada , ácido úrico ) con PRR inicia una respuesta celular. Las cascadas de señalización intracelular desencadenadas conducen a la regulación positiva de vías metabólicas como la glucólisis , el ciclo de Krebs y el metabolismo de los ácidos grasos . Un aumento en la actividad metabólica proporciona a las células energía y componentes básicos necesarios para la producción de moléculas de señalización como citocinas y quimiocinas . [17]
La transducción de señales cambia las marcas epigenéticas y aumenta la accesibilidad a la cromatina, para permitir la unión de factores de transcripción e iniciar la transcripción de genes relacionados con la inflamación. Existe una interacción entre el metabolismo y los cambios epigenéticos porque algunos metabolitos como el fumarato y el acetil-CoA pueden activar o inhibir las enzimas implicadas en la remodelación de la cromatina . [16] Una vez que el estímulo cesa, no hay necesidad de producir factores inmunitarios y su expresión en las células inmunitarias finaliza. Quedan varias modificaciones epigenéticas creadas durante la estimulación. El recableado epigenético característico en células entrenadas es la acumulación de H3K4me3 en los promotores de genes inmunes y el aumento de H3k4me1 y H3K27ac en los potenciadores. Además, el metabolismo celular no vuelve al estado anterior a la estimulación y las células entrenadas permanecen en un estado preparado. Este estado puede durar desde semanas hasta varios meses y puede transmitirse a las células hijas. La estimulación secundaria induce una nueva respuesta, que es más rápida y más fuerte. [16] [17]
La memoria inmune aporta una importante ventaja evolutiva cuando el organismo se enfrenta a infecciones repetidas. La inflamación es muy costosa y una mayor eficacia de la respuesta acelera la eliminación de patógenos y previene daños al propio tejido del huésped. La memoria inmune adaptativa clásica evolucionó en los vertebrados con mandíbulas y en los peces sin mandíbulas ( lamprea ), que representan aproximadamente solo el 1% de los organismos vivos. Por lo tanto, se informa alguna forma de memoria inmune en otras especies. En plantas e invertebrados, una cinética más rápida, una mayor magnitud de la respuesta inmune y una mejor tasa de supervivencia pueden parecer después de encuentros con infecciones secundarias. La memoria inmune es común a la gran mayoría de la biodiversidad de la Tierra. [20]
Se ha propuesto que la memoria inmune en la inmunidad innata y adaptativa representa un continuo evolutivo en el que primero evolucionó una respuesta inmune más robusta, mediada por la reprogramación epigenética. Por el contrario, la especificidad a través de receptores específicos de antígeno evolucionó más tarde en algunos vertebrados. [21]