La energía de enlace nuclear en física experimental es la energía mínima que se requiere para desarmar el núcleo de un átomo en sus protones y neutrones constituyentes , conocidos colectivamente como nucleones . La energía de enlace para núcleos estables es siempre un número positivo, ya que el núcleo debe ganar energía para que los nucleones se separen unos de otros. Los nucleones se atraen entre sí por la fuerza nuclear fuerte . En física nuclear teórica, la energía de enlace nuclear se considera un número negativo. En este contexto, representa la energía del núcleo en relación con la energía de los nucleones constituyentes cuando están infinitamente separados. Tanto el punto de vista experimental como el teórico son equivalentes, con un énfasis ligeramente diferente en lo que significa la energía de enlace.
La masa de un núcleo atómico es menor que la suma de las masas individuales de los protones y neutrones que lo componen. La diferencia de masa se puede calcular mediante la ecuación de Einstein , E = mc2 , donde E es la energía de enlace nuclear, c es la velocidad de la luz y m es la diferencia de masa. Esta "masa faltante" se conoce como defecto de masa y representa la energía que se liberó cuando se formó el núcleo. [1]
El término "energía de enlace nuclear" también puede referirse al balance energético en procesos en los que el núcleo se divide en fragmentos compuestos por más de un nucleón. Si hay nueva energía de enlace disponible cuando se fusionan núcleos ligeros ( fusión nuclear ), o cuando se dividen núcleos pesados ( fisión nuclear ), cualquiera de los dos procesos puede dar como resultado la liberación de esta energía de enlace. Esta energía puede estar disponible como energía nuclear y puede usarse para producir electricidad, como en la energía nuclear , o en un arma nuclear . Cuando un núcleo grande se divide en pedazos, el exceso de energía se emite en forma de rayos gamma y la energía cinética de varias partículas expulsadas ( productos de fisión nuclear ).
Estas energías y fuerzas de enlace nuclear son del orden de un millón de veces mayores que las energías de enlace de los electrones de átomos ligeros como el hidrógeno . [2]
En las reacciones nucleares o desintegración radiactiva se produce una absorción o liberación de energía nuclear ; las que absorben energía se denominan reacciones endotérmicas y las que liberan energía se denominan reacciones exotérmicas . La energía se consume o se libera debido a las diferencias en la energía de enlace nuclear entre los productos entrantes y salientes de la transmutación nuclear. [3]
Las clases más conocidas de transmutaciones nucleares exotérmicas son la fisión nuclear y la fusión nuclear . La energía nuclear puede liberarse por fisión, cuando los núcleos atómicos pesados (como el uranio y el plutonio) se descomponen en núcleos más ligeros. La energía de la fisión se utiliza para generar energía eléctrica en cientos de lugares en todo el mundo. La energía nuclear también se libera durante la fusión, cuando los núcleos ligeros como el hidrógeno se combinan para formar núcleos más pesados como el helio. El Sol y otras estrellas utilizan la fusión nuclear para generar energía térmica que luego se irradia desde la superficie, un tipo de nucleosíntesis estelar. En cualquier proceso nuclear exotérmico, la masa nuclear puede convertirse en última instancia en energía térmica, emitida en forma de calor.
Para cuantificar la energía liberada o absorbida en cualquier transmutación nuclear, es necesario conocer las energías de enlace nuclear de los componentes nucleares involucrados en la transmutación.
Los electrones y los núcleos se mantienen unidos por atracción electrostática (lo negativo atrae a lo positivo). Además, a veces los electrones son compartidos por átomos vecinos o transferidos a ellos (mediante procesos de física cuántica ); este vínculo entre átomos se denomina enlace químico y es responsable de la formación de todos los compuestos químicos . [4]
La fuerza eléctrica no mantiene unidos a los núcleos, porque todos los protones tienen una carga positiva y se repelen entre sí. Si dos protones se tocaran, su fuerza de repulsión sería de casi 40 newtons. Como cada uno de los neutrones tiene una carga total de cero, un protón podría atraer eléctricamente a un neutrón si el protón pudiera inducir al neutrón a polarizarse eléctricamente . Sin embargo, tener al neutrón entre dos protones (de modo que su repulsión mutua disminuya a 10 N) atraería al neutrón solo para una disposición cuadrupolo eléctrico (− + + −) . Los multipolos más altos, necesarios para satisfacer más protones, causan una atracción más débil y rápidamente se vuelven inverosímiles.
Después de medir y verificar los momentos magnéticos de los protones y los neutrones , se hizo evidente que sus fuerzas magnéticas podrían ser de 20 o 30 newtons, atractivas si están correctamente orientadas. Un par de protones realizaría entre sí un trabajo de 10 −13 julios al aproximarse, es decir, necesitarían liberar una energía de 0,5 MeV para permanecer unidos. Por otro lado, una vez que un par de nucleones se adhieren magnéticamente, sus campos externos se reducen considerablemente, por lo que es difícil que muchos nucleones acumulen mucha energía magnética.
Por lo tanto, otra fuerza, llamada fuerza nuclear (o fuerza fuerte residual ), mantiene unidos los nucleones de los núcleos. Esta fuerza es un residuo de la interacción fuerte , que une a los quarks en nucleones a un nivel de distancia aún menor.
El hecho de que los núcleos no se agrupen (se fusionen) en condiciones normales sugiere que la fuerza nuclear debe ser más débil que la repulsión eléctrica a distancias mayores, pero más fuerte a corta distancia. Por lo tanto, tiene características de corto alcance. Una analogía de la fuerza nuclear es la fuerza entre dos imanes pequeños: los imanes son muy difíciles de separar cuando están pegados, pero una vez que se separan a una distancia corta, la fuerza entre ellos cae casi a cero. [4]
A diferencia de la gravedad o las fuerzas eléctricas, la fuerza nuclear es efectiva sólo a distancias muy cortas. A distancias mayores, domina la fuerza electrostática: los protones se repelen entre sí porque tienen carga positiva, y cargas iguales se repelen. Por esa razón, los protones que forman los núcleos del hidrógeno ordinario —por ejemplo, en un globo lleno de hidrógeno— no se combinan para formar helio (un proceso que también requeriría que algunos protones se combinen con electrones y se conviertan en neutrones ). No pueden acercarse lo suficiente para que la fuerza nuclear, que los atrae entre sí, sea importante. Sólo en condiciones de presión y temperatura extremas (por ejemplo, dentro del núcleo de una estrella ), puede tener lugar un proceso de este tipo. [5]
Existen alrededor de 94 elementos naturales en la Tierra. Los átomos de cada elemento tienen un núcleo que contiene una cantidad específica de protones (siempre la misma cantidad para un elemento dado) y una cantidad de neutrones , que a menudo es aproximadamente una cantidad similar. Dos átomos del mismo elemento que tienen diferentes cantidades de neutrones se conocen como isótopos del elemento. Diferentes isótopos pueden tener diferentes propiedades; por ejemplo, uno puede ser estable y otro puede ser inestable, y gradualmente sufrir una desintegración radiactiva para convertirse en otro elemento.
El núcleo de hidrógeno contiene sólo un protón. Su isótopo deuterio, o hidrógeno pesado , contiene un protón y un neutrón. El isótopo más común del helio contiene dos protones y dos neutrones, y los del carbono, nitrógeno y oxígeno, seis, siete y ocho de cada partícula, respectivamente. Sin embargo, un núcleo de helio pesa menos que la suma de los pesos de los dos núcleos de hidrógeno pesado que se combinan para formarlo. [6] Lo mismo ocurre con el carbono, el nitrógeno y el oxígeno. Por ejemplo, el núcleo de carbono es ligeramente más ligero que tres núcleos de helio, que pueden combinarse para formar un núcleo de carbono. Esta diferencia se conoce como defecto de masa.
El defecto de masa (también llamado "déficit de masa") es la diferencia entre la masa de un objeto y la suma de las masas de sus partículas constituyentes. Descubierto por Albert Einstein en 1905, se puede explicar utilizando su fórmula E = mc2 , que describe la equivalencia de energía y masa . La disminución de masa es igual a la energía emitida en la reacción de creación de un átomo dividida por c2 . [7] Según esta fórmula, añadir energía también aumenta la masa (tanto el peso como la inercia), mientras que quitar energía disminuye la masa. Por ejemplo, un átomo de helio que contiene cuatro nucleones tiene una masa aproximadamente un 0,8% menor que la masa total de cuatro átomos de hidrógeno (cada uno de ellos con un nucleón). El núcleo de helio tiene cuatro nucleones unidos entre sí, y la energía de enlace que los mantiene unidos es, en efecto, el 0,8% de masa faltante. [8] [9]
En el caso de los elementos más ligeros, la energía que se puede liberar al ensamblarlos a partir de elementos más ligeros disminuye, y se puede liberar energía cuando se fusionan. Esto es cierto para los núcleos más ligeros que el hierro / níquel . En el caso de los núcleos más pesados, se necesita más energía para unirlos, y esa energía se puede liberar al romperlos en fragmentos (lo que se conoce como fisión nuclear ). En la actualidad, la energía nuclear se genera rompiendo núcleos de uranio en reactores nucleares y capturando la energía liberada en forma de calor, que se convierte en electricidad.
Por regla general, los elementos muy ligeros pueden fusionarse con relativa facilidad, y los elementos muy pesados pueden romperse por fisión con mucha facilidad; los elementos intermedios son más estables y es difícil hacer que experimenten fusión o fisión en un entorno como un laboratorio.
La razón por la que la tendencia se invierte después del hierro es la creciente carga positiva de los núcleos, que tiende a forzar la ruptura de los núcleos. A esta resistencia se opone la interacción nuclear fuerte , que mantiene unidos a los nucleones. La fuerza eléctrica puede ser más débil que la fuerza nuclear fuerte, pero la fuerza fuerte tiene un alcance mucho más limitado: en un núcleo de hierro, cada protón repele a los otros 25 protones, mientras que la fuerza nuclear solo une a los vecinos cercanos. Por lo tanto, en el caso de núcleos más grandes, las fuerzas electrostáticas tienden a dominar y el núcleo tenderá a romperse con el tiempo.
A medida que los núcleos se hacen más grandes, este efecto disruptivo se hace cada vez más significativo. Cuando se llega al polonio (84 protones), los núcleos ya no pueden acomodar su gran carga positiva, sino que emiten sus protones excedentes con bastante rapidez en el proceso de radiactividad alfa, la emisión de núcleos de helio, cada uno con dos protones y dos neutrones. (Los núcleos de helio son una combinación especialmente estable). Debido a este proceso, los núcleos con más de 94 protones no se encuentran de forma natural en la Tierra (véase la tabla periódica ). Los isótopos más allá del uranio (número atómico 92) con las vidas medias más largas son el plutonio-244 (80 millones de años) y el curio-247 (16 millones de años).
El proceso de fusión nuclear funciona de la siguiente manera: hace cinco mil millones de años, el nuevo Sol se formó cuando la gravedad atrajo hacia sí una enorme nube de hidrógeno y polvo, de la que también surgieron la Tierra y otros planetas. La atracción gravitatoria liberó energía y calentó el Sol primitivo, de forma muy similar a la propuesta de Helmholtz . [10]
La energía térmica se manifiesta como el movimiento de átomos y moléculas: cuanto más alta es la temperatura de un conjunto de partículas, mayor es su velocidad y más violentas son sus colisiones. Cuando la temperatura en el centro del recién formado Sol se volvió lo suficientemente alta como para que las colisiones entre los núcleos de hidrógeno superaran su repulsión eléctrica y los llevaran al rango corto de la fuerza nuclear atractiva , los núcleos comenzaron a pegarse entre sí. Cuando esto comenzó a suceder, los protones se combinaron en deuterio y luego en helio, y algunos protones se transformaron en neutrones (además de positrones, electrones positivos, que se combinan con electrones y se aniquilan en fotones de rayos gamma). Esta energía nuclear liberada ahora mantiene alta la temperatura del núcleo del Sol, y el calor también mantiene alta la presión del gas, manteniendo al Sol en su tamaño actual e impidiendo que la gravedad lo comprima más. Ahora hay un equilibrio estable entre la gravedad y la presión.
En distintas etapas de la existencia del Sol pueden predominar distintas reacciones nucleares, entre ellas la reacción protón-protón y el ciclo carbono-nitrógeno, que involucra núcleos más pesados, pero cuyo producto final sigue siendo la combinación de protones para formar helio.
Una rama de la física, el estudio de la fusión nuclear controlada , ha intentado desde los años 50 obtener energía útil de las reacciones de fusión nuclear que combinan núcleos pequeños para formar otros más grandes, normalmente para calentar calderas, cuyo vapor podría hacer girar turbinas y producir electricidad. Ningún laboratorio terrestre puede igualar una característica de la central eléctrica solar: la gran masa del Sol, cuyo peso mantiene comprimido el plasma caliente y confina el horno nuclear al núcleo del Sol. En cambio, los físicos utilizan fuertes campos magnéticos para confinar el plasma, y como combustible utilizan formas pesadas de hidrógeno, que se queman más fácilmente. Las trampas magnéticas pueden ser bastante inestables, y cualquier plasma lo suficientemente caliente y denso como para sufrir una fusión nuclear tiende a escaparse de ellas después de un corto tiempo. Incluso con trucos ingeniosos, el confinamiento en la mayoría de los casos dura solo una pequeña fracción de segundo.
Los núcleos pequeños, más grandes que el hidrógeno, pueden combinarse para formar otros más grandes y liberar energía, pero al combinarse, la cantidad de energía liberada es mucho menor en comparación con la fusión del hidrógeno. La razón es que, si bien el proceso general libera energía al permitir que la atracción nuclear haga su trabajo, primero se debe inyectar energía para unir a los protones con carga positiva, que también se repelen entre sí con su carga eléctrica. [5]
En el caso de elementos que pesan más que el hierro (un núcleo con 26 protones), el proceso de fusión ya no libera energía. En núcleos aún más pesados, la energía se consume, no se libera, al combinar núcleos de tamaño similar. Con núcleos tan grandes, superar la repulsión eléctrica (que afecta a todos los protones del núcleo) requiere más energía que la que se libera mediante la atracción nuclear (que es efectiva principalmente entre vecinos cercanos). Por el contrario, la energía podría liberarse al separar núcleos más pesados que el hierro. [5]
En los núcleos de elementos más pesados que el plomo , la repulsión eléctrica es tan fuerte que algunos de ellos expulsan espontáneamente fragmentos positivos, normalmente núcleos de helio que forman partículas alfa estables . Esta ruptura espontánea es una de las formas de radiactividad que presentan algunos núcleos. [5]
Los núcleos más pesados que el plomo (excepto el bismuto , el torio y el uranio ) se desintegran espontáneamente con demasiada rapidez como para aparecer en la naturaleza como elementos primordiales , aunque pueden producirse artificialmente o como intermediarios en las cadenas de desintegración de elementos más pesados. En general, cuanto más pesados son los núcleos, más rápido se desintegran espontáneamente. [5]
Los núcleos de hierro son los más estables (en particular el hierro-56 ), y las mejores fuentes de energía son, por tanto, los núcleos cuyo peso se aleja lo más posible del del hierro. Se pueden combinar los más ligeros (los núcleos de hidrógeno [protones]) para formar núcleos de helio, y así es como el Sol genera su energía. Alternativamente, se pueden romper los más pesados (los núcleos de uranio o plutonio) en fragmentos más pequeños, y eso es lo que hacen los reactores nucleares . [5]
Un ejemplo que ilustra la energía de enlace nuclear es el núcleo del carbono 12 (carbono-12), que contiene 6 protones y 6 neutrones. Los protones tienen carga positiva y se repelen entre sí, pero la fuerza nuclear supera la repulsión y hace que se adhieran entre sí. La fuerza nuclear es una fuerza de corto alcance (es muy atractiva a una distancia de 1,0 fm y se vuelve extremadamente pequeña más allá de una distancia de 2,5 fm), y prácticamente no se observa ningún efecto de esta fuerza fuera del núcleo. La fuerza nuclear también atrae a los neutrones, o a los neutrones y protones. [11]
La energía del núcleo es negativa con respecto a la energía de las partículas que se separan hasta una distancia infinita (como la energía gravitatoria de los planetas del Sistema Solar), porque se debe utilizar energía para dividir un núcleo en sus protones y neutrones individuales. Los espectrómetros de masas han medido las masas de los núcleos, que siempre son menores que la suma de las masas de los protones y neutrones que los forman, y la diferencia —según la fórmula E = mc2— da la energía de enlace del núcleo. [11]
La energía de enlace del helio es la fuente de energía del Sol y de la mayoría de las estrellas. [12] El Sol está compuesto en un 74 por ciento de hidrógeno (medido en masa), un elemento que tiene un núcleo formado por un solo protón. La energía se libera en el Sol cuando 4 protones se combinan en un núcleo de helio, un proceso en el que dos de ellos también se convierten en neutrones. [11]
La conversión de protones en neutrones es el resultado de otra fuerza nuclear, conocida como fuerza nuclear débil . La fuerza débil, al igual que la fuerza fuerte, tiene un alcance corto, pero es mucho más débil que la fuerza fuerte. La fuerza débil intenta hacer que el número de neutrones y protones alcance la configuración energéticamente más estable. Para los núcleos que contienen menos de 40 partículas, estos números suelen ser aproximadamente iguales. Los protones y los neutrones están estrechamente relacionados y se conocen colectivamente como nucleones. A medida que el número de partículas aumenta hacia un máximo de aproximadamente 209, el número de neutrones para mantener la estabilidad comienza a superar al número de protones, hasta que la relación de neutrones a protones es de aproximadamente tres a dos. [11]
Los protones del hidrógeno se combinan para formar helio sólo si tienen la velocidad suficiente para superar la repulsión mutua y llegar al alcance de la fuerte atracción nuclear. Esto significa que la fusión sólo se produce en un gas muy caliente. El hidrógeno lo suficientemente caliente como para combinarse para formar helio requiere una enorme presión para mantenerlo confinado, pero existen condiciones adecuadas en las regiones centrales del Sol, donde dicha presión la proporciona el enorme peso de las capas que se encuentran por encima del núcleo, presionadas hacia dentro por la fuerte gravedad del Sol. El proceso de combinación de protones para formar helio es un ejemplo de fusión nuclear. [11]
La producción de helio a partir de hidrógeno normal sería prácticamente imposible en la Tierra debido a la dificultad de crear deuterio . Se están realizando investigaciones para desarrollar un proceso que utilice deuterio y tritio . Los océanos de la Tierra contienen una gran cantidad de deuterio que podría usarse y el tritio puede fabricarse en el propio reactor a partir de litio , y además el producto de helio no daña el medio ambiente, por lo que algunos consideran que la fusión nuclear es una buena alternativa para satisfacer nuestras necesidades energéticas. Los experimentos para llevar a cabo esta forma de fusión hasta ahora solo han tenido un éxito parcial. El deuterio y el tritio deben estar suficientemente calientes. Una técnica es utilizar campos magnéticos muy fuertes, porque las partículas cargadas (como las atrapadas en el cinturón de radiación de la Tierra) son guiadas por líneas de campo magnético. [11]
En los principales isótopos de los elementos ligeros, como el carbono, el nitrógeno y el oxígeno, la combinación más estable de neutrones y protones se produce cuando los números son iguales (esto continúa hasta el elemento 20, el calcio). Sin embargo, en los núcleos más pesados, la energía disruptiva de los protones aumenta, ya que están confinados en un volumen minúsculo y se repelen entre sí. La energía de la fuerza fuerte que mantiene unido el núcleo también aumenta, pero a un ritmo más lento, como si dentro del núcleo, solo los nucleones cercanos entre sí estuvieran fuertemente unidos, no los que están más separados. [11]
La energía neta de enlace de un núcleo es la de la atracción nuclear, menos la energía disruptiva de la fuerza eléctrica. A medida que los núcleos se vuelven más pesados que el helio, su energía neta de enlace por nucleón (deducida de la diferencia de masa entre el núcleo y la suma de las masas de los nucleones componentes) crece cada vez más lentamente, alcanzando su pico en el hierro. A medida que se añaden nucleones, la energía total de enlace nuclear siempre aumenta, pero la energía disruptiva total de las fuerzas eléctricas (protones positivos que repelen a otros protones) también aumenta, y más allá del hierro, el segundo aumento supera al primero. El hierro-56 ( 56 Fe) es el núcleo más eficientemente unido [11], lo que significa que tiene la menor masa promedio por nucleón. Sin embargo, el níquel-62 es el núcleo más fuertemente unido en términos de energía de enlace por nucleón. [13] (La mayor energía de enlace del níquel-62 no se traduce en una pérdida de masa media mayor que la del 56 Fe, porque el 62 Ni tiene una relación de neutrones/protones ligeramente mayor que la del hierro-56, y la presencia de neutrones más pesados aumenta la masa media por nucleón del níquel-62).
Para reducir la energía disruptiva, la interacción débil permite que el número de neutrones supere al de protones; por ejemplo, el isótopo principal del hierro tiene 26 protones y 30 neutrones. También existen isótopos en los que el número de neutrones difiere del número más estable para ese número de nucleones. Si la transformación de un protón en un neutrón o de un neutrón en un protón aumenta la estabilidad (reduciendo la masa), esto ocurrirá a través de la desintegración beta , lo que significa que el nucleido será radiactivo.
Los dos métodos para esta conversión están mediados por la fuerza débil e involucran tipos de desintegración beta . En la desintegración beta más simple, los neutrones se convierten en protones emitiendo un electrón negativo y un antineutrino. Esto siempre es posible fuera de un núcleo porque los neutrones son más masivos que los protones por un equivalente de aproximadamente 2,5 electrones. En el proceso opuesto, que solo ocurre dentro de un núcleo, y no en partículas libres, un protón puede convertirse en un neutrón expulsando un positrón y un neutrino electrónico. Esto es posible si hay suficiente energía disponible entre los nucleidos padre e hijo para hacer esto (la diferencia de energía requerida es igual a 1,022 MeV, que es la masa de 2 electrones). Si la diferencia de masa entre padre e hijo es menor que esto, un núcleo rico en protones aún puede convertir protones en neutrones mediante el proceso de captura de electrones , en el que un protón simplemente captura un electrón de los electrones orbitales K del átomo, emite un neutrino y se convierte en un neutrón. [11]
Entre los núcleos más pesados, empezando por los núcleos de telurio (elemento 52) que contienen 104 o más nucleones, las fuerzas eléctricas pueden ser tan desestabilizadoras que pueden expulsarse trozos enteros del núcleo, normalmente como partículas alfa , que constan de dos protones y dos neutrones (las partículas alfa son núcleos rápidos de helio). ( El berilio-8 también se desintegra, muy rápidamente, en dos partículas alfa). Este tipo de desintegración se hace cada vez más probable a medida que los elementos aumentan en peso atómico más allá de 104.
La curva de energía de enlace es un gráfico que representa la energía de enlace por nucleón frente a la masa atómica. Esta curva tiene su pico principal en el hierro y el níquel y luego vuelve a disminuir lentamente, y también un pico estrecho y aislado en el helio, que es más estable que otros nucleidos de baja masa. Los núcleos más pesados en cantidades más que trazas en la naturaleza, el uranio 238 U, son inestables, pero al tener una vida media de 4.500 millones de años, cercana a la edad de la Tierra, siguen siendo relativamente abundantes; ellos (y otros núcleos más pesados que el helio) se han formado en eventos de evolución estelar como explosiones de supernovas [14] que precedieron a la formación del Sistema Solar . El isótopo más común del torio, el 232 Th, también experimenta emisión de partículas alfa, y su vida media (tiempo durante el cual se desintegra la mitad de un número de átomos) es incluso más larga, varias veces. En cada uno de ellos, la desintegración radiactiva produce isótopos hijos que también son inestables, iniciando una cadena de desintegraciones que termina en algún isótopo estable de plomo. [11]
Se puede emplear un cálculo para determinar la energía de enlace nuclear de los núcleos. El cálculo implica determinar el defecto de masa nuclear , convertirlo en energía y expresar el resultado como energía por mol de átomos o como energía por nucleón. [1]
El defecto de masa nuclear se define como la diferencia entre la masa nuclear y la suma de las masas de los nucleones constituyentes. Se expresa mediante
dónde:
El defecto de masa nuclear se convierte normalmente en energía de enlace nuclear, que es la energía mínima necesaria para descomponer el núcleo en sus nucleones constituyentes. Esta conversión se realiza con la equivalencia masa-energía : E = ∆mc². Sin embargo, debe expresarse como energía por mol de átomos o como energía por nucleón. [1]
La energía nuclear se libera por la división (fisión) o la fusión (fusión) de los núcleos de los átomos . La conversión de la masa - energía nuclear en una forma de energía que puede quitar algo de masa cuando se elimina la energía es consistente con la fórmula de equivalencia masa-energía :
dónde
y c = la velocidad de la luz en el vacío .
La energía nuclear fue descubierta por primera vez por el físico francés Henri Becquerel en 1896, cuando descubrió que las placas fotográficas almacenadas en la oscuridad cerca del uranio se ennegrecían como las placas de rayos X (los rayos X se habían descubierto recientemente en 1895). [15]
El níquel-62 tiene la energía de enlace por nucleón más alta de todos los isótopos . Si un átomo con una energía de enlace promedio más baja por nucleón se transforma en dos átomos con una energía de enlace promedio más alta por nucleón, se emite energía. (El promedio aquí es el promedio ponderado). Además, si dos átomos con una energía de enlace promedio más baja se fusionan en un átomo con una energía de enlace promedio más alta, se emite energía. El gráfico muestra que la fusión, o combinación, de núcleos de hidrógeno para formar átomos más pesados libera energía, al igual que la fisión del uranio, la ruptura de un núcleo más grande en partes más pequeñas.
La energía nuclear se libera mediante tres procesos exoenergéticos (o exotérmicos ):
La interacción nuclear productora de energía de los elementos ligeros requiere alguna aclaración. Con frecuencia, todas las interacciones nucleares productoras de energía de los elementos ligeros se clasifican como fusión, sin embargo, según la definición dada anteriormente, la fusión requiere que los productos incluyan un núcleo que sea más pesado que los reactivos. Los elementos ligeros pueden experimentar interacciones nucleares productoras de energía por fusión o fisión. Todas las interacciones nucleares productoras de energía entre dos isótopos de hidrógeno y entre hidrógeno y helio-3 son fusión, ya que el producto de estas interacciones incluye un núcleo más pesado. Sin embargo, la interacción nuclear productora de energía de un neutrón con litio-6 produce hidrógeno-3 y helio-4, cada uno un núcleo más ligero. Según la definición anterior, esta interacción nuclear es fisión, no fusión. Cuando la fisión es causada por un neutrón, como en este caso, se llama fisión inducida.
La energía de enlace de un átomo (incluidos sus electrones) no es exactamente la misma que la energía de enlace del núcleo del átomo. Los déficits de masa medidos de los isótopos siempre se enumeran como déficits de masa de los átomos neutros de ese isótopo, y principalmente en MeV/ c 2 . En consecuencia, los déficits de masa enumerados no son una medida de la estabilidad o la energía de enlace de los núcleos aislados, sino de los átomos en su totalidad. Existe una razón muy práctica para esto, a saber, que es muy difícil ionizar totalmente los elementos pesados, es decir, despojarlos de todos sus electrones .
Esta práctica también es útil por otras razones: quitar todos los electrones de un núcleo pesado inestable (produciendo así un núcleo desnudo) cambia la vida útil del núcleo, o el núcleo de un átomo neutro estable también puede volverse inestable después de quitarlo, lo que indica que el núcleo no puede tratarse de forma independiente. Se han mostrado ejemplos de esto en experimentos de desintegración β en estado ligado realizados en el acelerador de iones pesados GSI . [16] [17] Esto también es evidente a partir de fenómenos como la captura de electrones . Teóricamente, en los modelos orbitales de átomos pesados, el electrón orbita parcialmente dentro del núcleo (no orbita en sentido estricto, pero tiene una probabilidad no nula de estar ubicado dentro del núcleo).
Se produce una desintegración nuclear en el núcleo, lo que significa que las propiedades atribuidas al núcleo cambian en el evento. En el campo de la física, el concepto de "déficit de masa" como medida de "energía de enlace" significa "déficit de masa del átomo neutro" (no solo del núcleo) y es una medida de la estabilidad de todo el átomo.

En la tabla periódica de los elementos , se observa que la serie de elementos ligeros, desde el hidrógeno hasta el sodio, exhibe una energía de enlace por nucleón que generalmente aumenta a medida que aumenta la masa atómica . Este aumento se genera por el aumento de las fuerzas por nucleón en el núcleo, ya que cada nucleón adicional es atraído por otros nucleones cercanos y, por lo tanto, se une más fuertemente al conjunto. El helio-4 y el oxígeno-16 son excepciones particularmente estables a la tendencia (ver figura a la derecha). Esto se debe a que son doblemente mágicos , lo que significa que sus protones y neutrones llenan sus respectivas capas nucleares.
A la región de energía de enlace creciente le sigue una región de relativa estabilidad (saturación) en la secuencia que va desde aproximadamente la masa 30 hasta aproximadamente la masa 90. En esta región, el núcleo se ha vuelto lo suficientemente grande como para que las fuerzas nucleares ya no se extiendan completamente de manera eficiente a lo largo de su ancho. Las fuerzas nucleares atractivas en esta región, a medida que aumenta la masa atómica, se equilibran casi por completo con las fuerzas electromagnéticas repulsivas entre los protones, a medida que aumenta el número atómico .
Finalmente, en los elementos más pesados, se produce una disminución gradual de la energía de enlace por nucleón a medida que aumenta el número atómico. En esta región del tamaño nuclear, las fuerzas de repulsión electromagnética comienzan a superar la atracción de la fuerza nuclear fuerte.
En el pico de energía de enlace, el níquel-62 es el núcleo más fuertemente unido (por nucleón), seguido por el hierro-58 y el hierro-56 . [18] Esta es la razón básica aproximada por la que el hierro y el níquel son metales muy comunes en los núcleos planetarios, ya que se producen profusamente como productos finales en supernovas y en las etapas finales de la quema de silicio en las estrellas. Sin embargo, no es la energía de enlace por nucleón definido (como se definió anteriormente), la que controla exactamente qué núcleos se forman, porque dentro de las estrellas, los neutrones y los protones pueden interconvertirse para liberar incluso más energía por nucleón genérico. De hecho, se ha argumentado que la fotodesintegración de 62 Ni para formar 56 Fe puede ser energéticamente posible en un núcleo estelar extremadamente caliente, debido a esta conversión de desintegración beta de neutrones a protones. [19] Esto favorece la creación de 56 Fe, el nucleido con la masa más baja por nucleón. Sin embargo, a altas temperaturas no toda la materia estará en el estado de energía más bajo. Este máximo energético también debería ser válido para condiciones ambientales, digamos T = 298 K y p = 1 atm , para materia condensada neutra compuesta por 56 átomos de Fe; sin embargo, en estas condiciones los núcleos de los átomos no pueden fusionarse en el estado más estable y de menor energía de la materia.
Los elementos con alta energía de enlace por nucleón, como el hierro y el níquel, no pueden experimentar fisión, pero teóricamente pueden experimentar fusión con hidrógeno, deuterio, helio y carbono, por ejemplo: [20]
En general, se cree que el hierro-56 es más común que los isótopos de níquel en el universo por razones mecanicistas, porque su progenitor inestable, el níquel-56, se produce copiosamente mediante la acumulación gradual de 14 núcleos de helio dentro de las supernovas, donde no tiene tiempo de desintegrarse en hierro antes de liberarse al medio interestelar en cuestión de unos pocos minutos, cuando la supernova explota. Sin embargo, el níquel-56 luego se desintegra en cobalto-56 en unas pocas semanas, luego este radioisótopo finalmente se desintegra en hierro-56 con una vida media de aproximadamente 77,3 días. Se ha observado que la curva de luz impulsada por la desintegración radiactiva de dicho proceso ocurre en supernovas de tipo II , como SN 1987A . En una estrella, no hay buenas formas de crear níquel-62 mediante procesos de adición alfa, o de lo contrario presumiblemente habría más de este nucleido altamente estable en el universo.
El hecho de que la máxima energía de enlace se encuentre en núcleos de tamaño medio es una consecuencia de la compensación de los efectos de dos fuerzas opuestas que tienen diferentes características de alcance. La fuerza nuclear atractiva ( fuerza nuclear fuerte ), que une a los protones y neutrones por igual entre sí, tiene un alcance limitado debido a una rápida disminución exponencial de esta fuerza con la distancia. Sin embargo, la fuerza electromagnética de repulsión, que actúa entre los protones para separar los núcleos, disminuye con la distancia mucho más lentamente (como el cuadrado inverso de la distancia). Para núcleos mayores de aproximadamente cuatro nucleones de diámetro, la fuerza de repulsión adicional de protones adicionales compensa con creces cualquier energía de enlace que resulte entre más nucleones agregados como resultado de interacciones adicionales de fuerza fuerte. Dichos núcleos se vuelven cada vez menos fuertemente unidos a medida que aumenta su tamaño, aunque la mayoría de ellos aún son estables. Por último, los núcleos que contienen más de 209 nucleones (más grandes que unos 6 nucleones de diámetro) son demasiado grandes para ser estables y están sujetos a la desintegración espontánea en núcleos más pequeños.
La fusión nuclear produce energía combinando los elementos más ligeros en elementos más fuertemente unidos (como el hidrógeno en helio ), y la fisión nuclear produce energía dividiendo los elementos más pesados (como el uranio y el plutonio ) en elementos más fuertemente unidos (como el bario y el criptón ). La fisión nuclear de unos pocos elementos ligeros (como el litio) ocurre porque el helio-4 es un producto y un elemento más fuertemente unido que los elementos ligeramente más pesados. Ambos procesos producen energía ya que la suma de las masas de los productos es menor que la suma de las masas de los núcleos que reaccionan.
Como se ha visto anteriormente en el ejemplo del deuterio, las energías de enlace nuclear son lo suficientemente grandes como para que puedan medirse fácilmente como déficits de masa fraccionaria , según la equivalencia de masa y energía. La energía de enlace atómico es simplemente la cantidad de energía (y masa) liberada cuando un conjunto de nucleones libres se unen para formar un núcleo .
La energía de enlace nuclear se puede calcular a partir de la diferencia de masas de un núcleo y la suma de las masas de los neutrones y protones libres que forman el núcleo. Una vez que se conoce esta diferencia de masas, llamada defecto de masa o deficiencia de masa, se puede utilizar la fórmula de equivalencia de masa-energía de Einstein E = mc2 para calcular la energía de enlace de cualquier núcleo. Los primeros físicos nucleares solían referirse al cálculo de este valor como un cálculo de "fracción de empaquetamiento".
Por ejemplo, el dalton (1 Da) se define como 1/12 de la masa de un átomo de 12 C, pero la masa atómica de un átomo de 1 H (que es un protón más un electrón) es 1,007825 Da, por lo que cada nucleón de 12 C ha perdido, en promedio, alrededor del 0,8% de su masa en forma de energía de enlace.
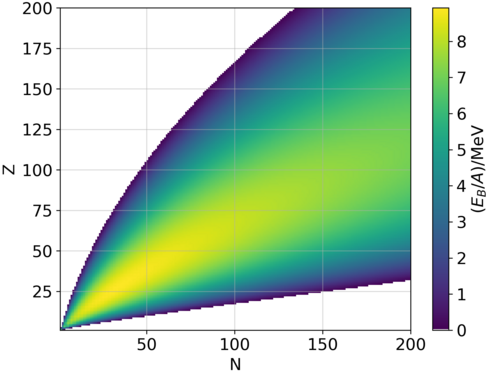
Para un núcleo con A nucleones, incluidos Z protones y N neutrones, una fórmula semiempírica para la energía de enlace ( E B ) por nucleón es: donde los coeficientes están dados por: ; ; ; ; .
El primer término se denomina contribución de saturación y garantiza que la energía de enlace por nucleón sea la misma para todos los núcleos en una primera aproximación. El término es un efecto de tensión superficial y es proporcional al número de nucleones que se encuentran en la superficie nuclear; es mayor para núcleos ligeros. El término es la repulsión electrostática de Coulomb; esto se vuelve más importante a medida que aumenta. El término de corrección de simetría tiene en cuenta el hecho de que, en ausencia de otros efectos, la disposición más estable tiene números iguales de protones y neutrones; esto se debe a que la interacción n–p en un núcleo es más fuerte que la interacción n−n o p−p. El término de emparejamiento es puramente empírico; es + para núcleos pares-pares y − para núcleos impares-impares . Cuando A es impar, el término de emparejamiento es idénticamente cero.
La siguiente tabla enumera algunas energías de enlace y valores de defecto de masa. [21] Observe también que usamos 1 Da = 931.494 028 (23) MeV/ c 2 . Para calcular la energía de enlace utilizamos la fórmula Z ( m p + m e ) + N m n − m nucleido donde Z denota el número de protones en los nucleidos y N su número de neutrones. Tomamos m p =938.272 0813 (58) MeV/ c 2 , m e =0,510 998 9461 (30) MeV/ c 2 y m n =939.565 4133 (58) MeV/ c 2 . La letra A denota la suma de Z y N (número de nucleones en el nucleido). Si asumimos que el nucleón de referencia tiene la masa de un neutrón (de modo que todas las energías de enlace "totales" calculadas sean máximas), podríamos definir la energía de enlace total como la diferencia entre la masa del núcleo y la masa de una colección de neutrones libres A . En otras palabras, sería ( Z + N ) m n − m nucleido . La " energía de enlace total por nucleón" sería este valor dividido por A .
El 56 Fe tiene la masa específica de nucleón más baja de los cuatro nucleidos enumerados en esta tabla, pero esto no implica que sea el átomo más fuerte ligado por hadrón, a menos que la elección de los hadrones iniciales sea completamente libre. El hierro libera la mayor energía si se permite que 56 nucleones formen un nucleido, cambiando uno por otro si es necesario. La energía de enlace más alta por hadrón, con los hadrones comenzando con el mismo número de protones Z y nucleones totales A que en el núcleo ligado, es 62 Ni. Por lo tanto, el verdadero valor absoluto de la energía de enlace total de un núcleo depende de lo que se nos permita construir el núcleo. Si se permitiera que todos los núcleos de número de masa A se construyeran con neutrones A , entonces el 56 Fe liberaría la mayor energía por nucleón, ya que tiene una fracción mayor de protones que el 62 Ni. Sin embargo, si se requiere que los núcleos estén construidos con solo la misma cantidad de protones y neutrones que contienen, entonces el níquel-62 es el núcleo más fuertemente unido, por nucleón.
En la tabla anterior se puede ver que la desintegración de un neutrón, así como la transformación del tritio en helio-3, libera energía; por lo tanto, manifiesta un nuevo estado de enlace más fuerte cuando se mide contra la masa de un número igual de neutrones (y también un estado más ligero por número de hadrones totales). Tales reacciones no son impulsadas por cambios en las energías de enlace calculadas a partir de números N y Z previamente fijados de neutrones y protones, sino más bien por disminuciones en la masa total del nucleido/por nucleón, con la reacción. (Tenga en cuenta que la energía de enlace dada anteriormente para el hidrógeno-1 es la energía de enlace atómico, no la energía de enlace nuclear que sería cero).