La diapausa embrionaria [a] ( implantación tardía en mamíferos) es una estrategia reproductiva utilizada por varias especies animales en diferentes clases biológicas . En más de 130 tipos de mamíferos donde esto ocurre, el proceso ocurre en la etapa de blastocisto del desarrollo embrionario , [1] y se caracteriza por una reducción drástica o el cese completo de la actividad mitótica , deteniéndose con mayor frecuencia en la fase G 0 o G 1 de la división. [2]
En la diapausa embrionaria placentaria, el blastocisto no se implanta inmediatamente en el útero después de que la reproducción sexual haya dado lugar al cigoto , sino que permanece en este estado de latencia sin división hasta que las condiciones permitan que la unión a la pared uterina se realice de forma normal. [3] Como resultado, el período de gestación normal se extiende durante un tiempo específico de la especie. [4] [5]
La diapausa proporciona una ventaja de supervivencia a las crías, porque el nacimiento o la aparición de las crías se puede programar para que coincida con las condiciones más favorables, independientemente de cuándo se produce el apareamiento o la duración de la gestación; cualquier aumento de este tipo en las tasas de supervivencia de la progenie confiere una ventaja evolutiva .
Los organismos que pasan por diapausa embrionaria son capaces de sincronizar el nacimiento de las crías con las condiciones más favorables para el éxito reproductivo, independientemente de cuándo tuvo lugar el apareamiento. [3] Muchos factores diferentes pueden inducir la diapausa embrionaria, como la época del año, la temperatura, la lactancia y el suministro de alimentos. [3]
La diapausa embrionaria es un fenómeno relativamente extendido fuera de los mamíferos, con una ocurrencia conocida en los ciclos reproductivos de muchos insectos, nematodos, peces y otros vertebrados no mamíferos. [6] Se ha observado en aproximadamente 130 especies de mamíferos, [7] lo que supone menos del dos por ciento de todas las especies de mamíferos. [8] Estos incluyen ciertos roedores , osos , armadillos , mustélidos (por ejemplo, comadrejas y tejones ) y marsupiales (por ejemplo, canguros ). Algunos grupos solo tienen una especie que experimenta diapausa embrionaria, como el corzo en el orden Artiodactyla . [5]
Se ha logrado la inducción experimental del desarrollo discontinuo embrionario en especies que no pasan espontáneamente por la diapausa embrionaria en la naturaleza; se ha demostrado con éxito la detención reversible del desarrollo. Esto puede ser una prueba de la importancia evolutiva de este fenómeno, ya que la capacidad latente para la diapausa puede estar presente en un segmento de especies mucho más amplio que el que se sabe que ocurre de forma natural. [8] [9]
Todos los organismos multicelulares, desde su concepción, comienzan como un pequeño número de células y sólo crecen y se desarrollan a medida que esas células se dividen. En los organismos que son capaces de diapausa embrionaria, en condiciones reproductivas no ideales, se produce un cese de la división celular que impide que el embrión crezca y madure, retrasando la maduración del embrión hasta que las condiciones sean lo suficientemente ideales para promover la supervivencia de la descendencia y, en algunos casos, de la madre.
La regulación del ciclo celular en relación con la diapausa embrionaria se ha relacionado con el gen dacapo en la mosca de la fruta, responsable de inhibir la formación de complejos ciclina E-cdk2 necesarios para la síntesis de ADN. También hay evidencia que apunta a la regulación positiva del gen 1 de translocación de células B (Btg1) en el embrión de ratón durante la diapausa, otro regulador conocido del ciclo celular, responsable de inhibir la transición de G 0 /G 1 . Otros estudios han demostrado, inversamente, la falta de participación de reguladores más comunes del ciclo celular, como p53, dentro del modelo placentario de diapausa embrionaria. [2] Si bien se ha caracterizado gran parte de la regulación molecular involucrada en la activación de blastocistos latentes , se dispone de poca caracterización ampliamente aplicable con respecto a la entrada en diapausa y las condiciones que permiten que un blastocisto permanezca latente. Una vez que el embrión sale del paro de diapausa y reanuda el desarrollo normal, no se observan efectos adversos. [10]
Específicamente, en la diapausa embrionaria placentaria, este cese está provocado por el fracaso intencional del blastocisto en implantarse en la pared uterina, que es un componente esencial en la progresión del desarrollo en estas especies. [11] Las hormonas relacionadas con la implantación fallida también contribuyen al arresto embrionario. [9]
Existen dos formas distintas de diapausa embrionaria, que se caracterizan por diferentes condiciones de inicio. La diapausa facultativa se produce en respuesta a ciertos factores estresantes ambientales o metabólicos, como cambios drásticos de temperatura, alimentación o lactancia. [10] La diapausa obligada se produce regularmente en el ciclo reproductivo de la especie afectada y suele estar asociada a cambios estacionales y fotoperiodos. [10]
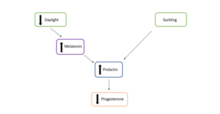
La diapausa facultativa está regulada por varios factores, incluido el entorno materno y la competencia ovárica, la glándula pituitaria, el estrés metabólico y la lactancia. [2]
En cuanto a los muchos otros reguladores de esta forma de diapausa, en los mamíferos placentarios, la diapausa facultativa suele ser el resultado de la fertilización poco después del nacimiento de una camada anterior. La consiguiente succión de las crías durante la lactancia promueve la liberación de prolactina . Esto, a su vez, reduce la secreción de progesterona del cuerpo lúteo en una hembra preñada. El cuerpo lúteo es un órgano endocrino temporal que se forma a partir de las células sobrantes del folículo ovárico en el ovario , una vez que ha liberado un óvulo maduro . La función principal del cuerpo lúteo es secretar progesterona durante el embarazo para mantener el entorno uterino necesario. La prolactina que actúa sobre el cuerpo lúteo hace que el nivel de progesterona esté por debajo de la concentración óptima y, por lo tanto, induce la diapausa facultativa embrionaria.
Cada especie que experimenta diapausa facultativa tiende a tener una etapa de desarrollo específica , que está determinada genéticamente, en la que se inicia este proceso. Esta forma de diapausa se ha estudiado mejor en roedores y marsupiales [2], pero se ha identificado en muchas otras especies, incluidos los no mamíferos. No está claro hasta qué punto los mecanismos estudiados para el inicio, el mantenimiento y la liberación de la diapausa facultativa en el modelo de roedores se aplican a estas otras especies.
La diapausa obligada (adj.: por necesidad) (también conocida como implantación retrasada estacional) es un mecanismo que garantiza que el nacimiento de las crías se produzca en condiciones ambientales óptimas, para asegurar la máxima supervivencia. [12] [9] El mecanismo propuesto es separar la concepción y el parto (nacimiento) para que cada uno pueda ocurrir en el momento más favorable del año. [9]
La diapausa obligada se activa y desactiva por cambios en el número de horas de luz dentro de un día (fotoperíodo) y, por lo tanto, ocurre dentro de estaciones específicas. [10] Si bien la diapausa obligada ocurre en una variedad de especies en diferentes grupos, existen variaciones significativas en la duración de la diapausa. Los zorrillos moteados occidentales ( Spilogale gracilis ) tienen una diapausa de alrededor de 200 días, mientras que los visones americanos ( Neogale vison ) solo tienen una diapausa de alrededor de catorce días. [10]
De manera similar a la diapausa facultativa, una serie de cambios hormonales detienen el desarrollo del blastocisto , antes de la implantación , impidiendo el crecimiento continuo del embrión. Sin embargo, en la diapausa obligada, el blastocisto entrará en estado latente en cada estación reproductiva. Esto significa que cada blastocisto que produce una madre entrará en un período de diapausa. [10]
La regulación estricta de la diapausa obligada es esencial para la supervivencia de la madre y la descendencia. La diapausa prematura puede dar lugar a la pérdida de oportunidades de crecimiento y reproducción, y la diapausa tardía puede dar lugar a la muerte debido a condiciones adversas. [13]
Antes del equinoccio de primavera , [b] el fotoperiodo es inferior a 12 horas. Esto aumenta la producción de melatonina en la glándula pineal . Debido a la relación inhibitoria entre la melatonina y la prolactina , este aumento de la melatonina disminuye la secreción de prolactina de la glándula pituitaria . La disminución de la prolactina disminuye en consecuencia la producción de progesterona en el cuerpo lúteo , impidiendo el desarrollo del blastocisto. Esto induce la diapausa embrionaria. [10]
Después del equinoccio de primavera, el fotoperiodo es mayor a 12 horas, lo que disminuye la producción de melatonina en la glándula pineal y, por lo tanto, aumenta la producción de prolactina y progesterona en la glándula pituitaria y el cuerpo lúteo respectivamente. [10]
El aumento de prolactina induce la expresión del gen Odc ( ornitina descarboxilasa ). El gen Odc produce la proteína ODC, una enzima limitante de la velocidad de producción de la poliamina putrescina en el entorno uterino . La presencia de putrescina puede indicar un papel en la inducción del escape del embrión de la diapausa obligada. [10]
Las células madre embrionarias (CME) tienen el potencial de permitir una mayor comprensión de los mecanismos que controlan la diapausa embrionaria. [13] Esto se debe a que las CME y los blastocistos en diapausa tienen perfiles de transcriptoma muy similares. [13] Las CME se derivan de las células de masa interna indiferenciadas de los blastocistos de un embrión, con la capacidad de proliferación continua in vitro. [13] Las CME se derivan principalmente de modelos de ratón, en el punto en el que las CME tienen una eficiencia óptima y pueden entrar en diapausa. [3]
Tanto los blastocistos en diapausa como las células madre embrionarias tienen similitudes en el perfil del transcriptoma, incluida la regulación negativa de las vías de metabolismo , biosíntesis y expresión genética . [3] Estas similitudes permiten el potencial de utilizar las células madre embrionarias como un modelo celular para identificar los factores moleculares que regulan la diapausa embrionaria. [13]