La temperatura termodinámica es una cantidad definida en la termodinámica como distinta de la teoría cinética o la mecánica estadística .
Históricamente, la temperatura termodinámica fue definida por Lord Kelvin en términos de una relación macroscópica entre el trabajo termodinámico y la transferencia de calor tal como se define en la termodinámica, pero el kelvin fue redefinido por acuerdo internacional en 2019 en términos de fenómenos que ahora se entienden como manifestaciones de la energía cinética del movimiento libre de partículas microscópicas como átomos, moléculas y electrones. Desde el punto de vista termodinámico, por razones históricas, debido a cómo se define y mide, esta definición cinética microscópica se considera una temperatura "empírica". Se adoptó porque en la práctica generalmente se puede medir con mayor precisión que la temperatura termodinámica de Kelvin.
Una temperatura termodinámica de cero es de particular importancia para la tercera ley de la termodinámica . Por convención, se expresa en la escala de temperatura Kelvin, en la que la unidad de medida es el kelvin (símbolo de la unidad: K). A modo de comparación, una temperatura de 295 K corresponde a 21,85 °C y 71,33 °F.
La temperatura termodinámica, a diferencia de la temperatura del SI, se define en términos de un ciclo macroscópico de Carnot. La temperatura termodinámica es importante en termodinámica porque se define en términos puramente termodinámicos. La temperatura del SI es conceptualmente muy diferente de la temperatura termodinámica. La temperatura termodinámica se definió rigurosamente históricamente mucho antes de que existiera un conocimiento adecuado de partículas microscópicas como átomos, moléculas y electrones.
El Sistema Internacional de Unidades (SI) especifica la escala absoluta internacional para medir la temperatura y la unidad de medida kelvin (símbolo de unidad: K) para valores específicos a lo largo de la escala. El kelvin también se utiliza para indicar intervalos de temperatura (un lapso o diferencia entre dos temperaturas) según el siguiente ejemplo de uso: "Una soldadura de estaño/plomo 60/40 no es eutéctica y es plástica en un rango de 5 kelvin a medida que se solidifica". Un intervalo de temperatura de un grado Celsius es la misma magnitud que un kelvin.
La magnitud del kelvin se redefinió en 2019 en relación con la propiedad física que subyace a la temperatura termodinámica: la energía cinética del movimiento de partículas atómicas libres. La revisión fijó la constante de Boltzmann exactamente en1,380 649 × 10 −23 julios por kelvin (J/K). [1]
La propiedad microscópica que confiere temperatura a las sustancias materiales se puede entender fácilmente examinando la ley de los gases ideales , que relaciona, según la constante de Boltzmann, cómo la energía térmica causa cambios definidos con precisión en la presión y la temperatura de ciertos gases. Esto se debe a que los gases monoatómicos como el helio y el argón se comportan cinéticamente como bolas de billar perfectamente elásticas y esféricas que se mueven libremente y que solo se mueven en un subconjunto específico de los movimientos posibles que pueden ocurrir en la materia: el que comprende los tres grados de libertad traslacionales . Los grados de libertad traslacionales son los movimientos familiares similares a los de las bolas de billar a lo largo de los ejes X, Y y Z del espacio 3D (ver la figura 1, a continuación). Esta es la razón por la que todos los gases nobles tienen la misma capacidad calorífica específica por átomo y por qué ese valor es el más bajo de todos los gases.
Las moléculas (dos o más átomos unidos químicamente), sin embargo, tienen una estructura interna y por lo tanto tienen grados de libertad internos adicionales (ver Figura 3, abajo), lo que hace que las moléculas absorban más energía térmica para cualquier cantidad dada de aumento de temperatura que los gases monoatómicos. La energía térmica nace en todos los grados de libertad disponibles; esto está de acuerdo con el teorema de equipartición , por lo que todos los grados de libertad internos disponibles tienen la misma temperatura que sus tres grados de libertad externos. Sin embargo, la propiedad que da a todos los gases su presión , que es la fuerza neta por unidad de área sobre un recipiente que surge de las partículas de gas que retroceden de él, es una función de la energía cinética transmitida en los tres grados de libertad de traslación de los átomos y moléculas que se mueven libremente. [2]
La fijación de la constante de Boltzmann en un valor específico, junto con otras reglas, tuvo el efecto de establecer con precisión la magnitud del intervalo unitario de temperatura del SI, el kelvin, en términos del comportamiento cinético promedio de los gases nobles. Además, el punto de partida de la escala de temperatura termodinámica, el cero absoluto, se reafirmó como el punto en el que la energía cinética promedio cero permanece en una muestra; el único movimiento de partículas restante es el que comprende vibraciones aleatorias debido a la energía del punto cero.
Las escalas de temperatura son numéricas. El cero numérico de una escala de temperatura no está ligado al cero absoluto de temperatura. Sin embargo, algunas escalas de temperatura tienen su cero numérico coincidente con el cero absoluto de temperatura. Algunos ejemplos son la escala de temperatura del SI internacional, la escala de temperatura Rankine y la escala de temperatura termodinámica. Otras escalas de temperatura tienen su cero numérico alejado del cero absoluto de temperatura. Algunos ejemplos son la escala Fahrenheit y la escala Celsius.
En el punto cero de la temperatura termodinámica, el cero absoluto , las partículas constituyentes de la materia tienen un movimiento mínimo y no pueden enfriarse más. [3] [4] El cero absoluto, que es una temperatura de cero kelvin (0 K), corresponde exactamente a −273,15 °C y −459,67 °F. La materia en el cero absoluto no tiene energía cinética media transferible restante y el único movimiento de partículas restante se debe a un fenómeno mecánico cuántico omnipresente llamado ZPE ( energía del punto cero ). [5] Aunque los átomos en, por ejemplo, un recipiente de helio líquido que estuviera precisamente en cero absoluto todavía se moverían ligeramente debido a la energía del punto cero, un motor térmico teóricamente perfecto con dicho helio como uno de sus fluidos de trabajo nunca podría transferir ninguna energía cinética neta ( energía térmica ) al otro fluido de trabajo y no podría ocurrir ningún trabajo termodinámico .
La temperatura se expresa generalmente en términos absolutos cuando se examinan científicamente las interrelaciones de la temperatura con ciertas otras propiedades físicas de la materia, como su volumen o presión (véase la ley de Gay-Lussac ), o la longitud de onda de la radiación de cuerpo negro emitida . La temperatura absoluta también es útil para calcular las velocidades de las reacciones químicas (véase la ecuación de Arrhenius ). Además, la temperatura absoluta se utiliza normalmente en criogenia y fenómenos relacionados como la superconductividad , según el siguiente ejemplo de uso: "Convenientemente, la temperatura de transición del tantalio ( Tc ) de 4,4924 kelvin es ligeramente superior al punto de ebullición del helio de 4,2221 K".
La constante de Boltzmann y sus fórmulas relacionadas describen el ámbito de la cinética de partículas y los vectores de velocidad, mientras que la ZPE ( energía de punto cero ) es un campo de energía que empuja las partículas de formas descritas por las matemáticas de la mecánica cuántica. En las colisiones atómicas y moleculares en gases, la ZPE introduce un grado de caos , es decir, imprevisibilidad, a la cinética de rebote; es tan probable que haya menos movimiento de partículas inducido por la ZPE después de una colisión dada como más . Esta naturaleza aleatoria de la ZPE es la razón por la que no tiene un efecto neto ni sobre la presión ni sobre el volumen de ninguna cantidad a granel (una cantidad estadísticamente significativa de partículas) de gases. Sin embargo, en materia condensada a temperatura T = 0 ; por ejemplo, sólidos y líquidos, la ZPE causa empujones interatómicos donde los átomos de otro modo estarían perfectamente estacionarios. Dado que los efectos del mundo real que la ZPE tiene sobre las sustancias pueden variar a medida que se altera un sistema termodinámico (por ejemplo, debido a la ZPE, el helio no se congelará a menos que esté bajo una presión de al menos 2,5 MPa (25 bar )), la ZPE es en gran medida una forma de energía térmica y puede incluirse adecuadamente al calcular la energía interna de una sustancia.
Aunque ha habido muchas otras escalas de temperatura a lo largo de la historia, solo ha habido dos escalas para medir la temperatura termodinámica que tienen el cero absoluto como su punto nulo (0): la escala Kelvin y la escala Rankine.
En todo el mundo científico, donde las mediciones modernas casi siempre se realizan utilizando el Sistema Internacional de Unidades, la temperatura termodinámica se mide utilizando la escala Kelvin. La escala Rankine es parte de las unidades de ingeniería inglesas y se utiliza en ciertos campos de ingeniería, en particular en obras de referencia antiguas. La escala Rankine utiliza el grado Rankine (símbolo: °R) como unidad, que es la misma magnitud que el grado Fahrenheit (símbolo: °F).
Un incremento unitario de un kelvin es exactamente 1,8 veces un grado Rankine; por lo tanto, para convertir una temperatura específica en la escala Kelvin a la escala Rankine, x K = 1,8 x °R , y para convertir de una temperatura en la escala Rankine a la escala Kelvin, x °R = x /1,8 K . En consecuencia, el cero absoluto es "0" para ambas escalas, pero el punto de fusión del hielo de agua (0 °C y 273,15 K) es 491,67 °R.
Para convertir intervalos de temperatura (un lapso o diferencia entre dos temperaturas), son aplicables las fórmulas del párrafo anterior; por ejemplo, un intervalo de 5 kelvin es exactamente igual a un intervalo de 9 grados Rankine.
Durante 65 años, entre 1954 y la revisión de 2019 del SI , un intervalo de temperatura de un kelvin se definió como 1/273,16 la diferencia entre el punto triple del agua y el cero absoluto. La resolución de 1954 de la Oficina Internacional de Pesos y Medidas (conocida por el acrónimo en francés BIPM), más resoluciones y publicaciones posteriores, definieron el punto triple del agua como exactamente 273,16 K y reconocieron que era una "práctica común" aceptar que debido a convenciones anteriores (a saber, que 0 °C se había definido durante mucho tiempo como el punto de fusión del agua y que el punto triple del agua se había determinado experimentalmente durante mucho tiempo como indistinguiblemente cercano a 0,01 °C), la diferencia entre la escala Celsius y la escala Kelvin se acepta como 273,15 kelvins; es decir, 0 °C corresponde a 273,15 kelvins. [6] El efecto neto de esta resolución y de las posteriores fue doble: 1) definieron el cero absoluto exactamente como 0 K, y 2) definieron que el punto triple del agua especial controlada isotópicamente llamada Agua Oceánica Media Estándar de Viena se producía exactamente a 273,16 K y 0,01 °C. Un efecto de las resoluciones antes mencionadas fue que el punto de fusión del agua, aunque muy cercano a 273,15 K y 0 °C, no era un valor definitorio y estaba sujeto a refinamiento con mediciones más precisas.
La norma BIPM de 1954 hizo un buen trabajo al establecer, dentro de las incertidumbres debidas a las variaciones isotópicas entre muestras de agua, temperaturas en torno a los puntos de congelación y triple del agua, pero requirió que los valores intermedios entre el punto triple y el cero absoluto, así como los valores extrapolados de la temperatura ambiente y más allá, se determinaran experimentalmente mediante aparatos y procedimientos en laboratorios individuales. Esta deficiencia fue abordada por la Escala Internacional de Temperatura de 1990 , o ITS-90, que definió 13 puntos adicionales, desde 13,8033 K, hasta 1.357,77 K. Si bien es definitoria, la ITS-90 tuvo (y todavía tiene) algunos desafíos, en parte porque ocho de sus valores extrapolados dependen de los puntos de fusión o congelación de las muestras de metal, que deben permanecer extremadamente puras para que sus puntos de fusión o congelación no se vean afectados, generalmente deprimidos.
La revisión del SI de 2019 tuvo como objetivo principal disociar gran parte de los fundamentos definitorios del sistema SI del kilogramo , que era el último artefacto físico que definía una unidad base del SI (un cilindro de platino/iridio almacenado bajo tres campanas de cristal anidadas en una caja fuerte ubicada en Francia) y que tenía una estabilidad altamente cuestionable. La solución requería que cuatro constantes físicas, incluida la constante de Boltzmann, fueran fijas definitoriamente.
La asignación de un valor definido con precisión a la constante de Boltzmann no tuvo ningún efecto práctico en la termometría moderna, excepto para las mediciones más precisas. Antes de la revisión, el punto triple del agua era exactamente 273,16 K y 0,01 °C y se determinó experimentalmente que la constante de Boltzmann era1.380 649 03 (51) × 10 −23 J/K , donde "(51)" denota la incertidumbre en los dos dígitos menos significativos (el 03) y equivale a una incertidumbre estándar relativa de 0,37 ppm. [7] Posteriormente, al definir la constante de Boltzmann como exactamente1.380 649 × 10 −23 J/K , la incertidumbre de 0,37 ppm se transfirió al punto triple del agua, que se convirtió en un valor determinado experimentalmente de273,1600 ± 0,0001 K (0,0100 ± 0,0001 °C ). Que el punto triple del agua acabara siendo excesivamente cercano a 273,16 K después de la revisión del SI no fue casualidad; el valor final de la constante de Boltzmann se determinó, en parte, mediante ingeniosos experimentos con argón y helio que utilizaron el punto triple del agua como su temperatura de referencia clave. [8] [9]
A pesar de la revisión de 2019, las celdas de punto triple de agua siguen sirviendo en la termometría moderna como referencias de calibración sumamente precisas a 273,16 K y 0,01 °C. Además, el punto triple del agua sigue siendo uno de los 14 puntos de calibración que componen la ITS-90, que abarca desde el punto triple del hidrógeno (13,8033 K) hasta el punto de congelación del cobre (1357,77 K), que es un rango de temperatura termodinámica de casi cien veces.
La temperatura termodinámica de cualquier cantidad de una sustancia (una cantidad estadísticamente significativa de partículas) es directamente proporcional a la energía cinética media promedio de un tipo específico de movimiento de partículas conocido como movimiento de traslación . Estos movimientos simples en las tres dimensiones del eje X, Y y Z del espacio significan que las partículas se mueven en los tres grados espaciales de libertad . Esta forma particular de energía cinética a veces se denomina temperatura cinética . El movimiento de traslación es solo una forma de energía térmica y es lo que le da a los gases no solo su temperatura, sino también su presión y la gran mayoría de su volumen. Esta relación entre la temperatura, la presión y el volumen de los gases se establece mediante la fórmula de la ley de los gases ideales pV = nRT y está incorporada en las leyes de los gases .
Aunque la energía cinética que se encuentra exclusivamente en los tres grados de libertad traslacionales comprende la temperatura termodinámica de una sustancia, las moléculas, como se puede ver en la figura 3, pueden tener otros grados de libertad, todos los cuales se incluyen en tres categorías: longitud de enlace, ángulo de enlace y rotacional. Las tres categorías adicionales no están necesariamente disponibles para todas las moléculas, e incluso para las moléculas que pueden experimentar las tres, algunas pueden quedar "congeladas" por debajo de una cierta temperatura. No obstante, todos esos grados de libertad que están disponibles para las moléculas bajo un conjunto particular de condiciones contribuyen a la capacidad calorífica específica de una sustancia; es decir, aumentan la cantidad de calor (energía cinética) necesaria para elevar una cantidad dada de la sustancia en un kelvin o un grado Celsius.
La relación entre la energía cinética, la masa y la velocidad viene dada por la fórmula E k = 1/2 mv 2 . [10] En consecuencia, las partículas con una unidad de masa que se mueven a una unidad de velocidad tienen exactamente la misma energía cinética y exactamente la misma temperatura que aquellas con cuatro veces la masa pero la mitad de la velocidad.
La medida en que la energía cinética del movimiento de traslación en un conjunto estadísticamente significativo de átomos o moléculas en un gas contribuye a la presión y el volumen de ese gas es una función proporcional de la temperatura termodinámica, como se establece mediante la constante de Boltzmann (símbolo: k B ). La constante de Boltzmann también relaciona la temperatura termodinámica de un gas con la energía cinética media del movimiento de traslación de partículas individuales , como sigue: donde:

Aunque la constante de Boltzmann es útil para encontrar la energía cinética media en una muestra de partículas, es importante notar que incluso cuando una sustancia está aislada y en equilibrio termodinámico (todas las partes están a una temperatura uniforme y no entra ni sale calor de ella), los movimientos de traslación de átomos y moléculas individuales ocurren en un amplio rango de velocidades (ver animación en la Fig. 1 arriba). En cualquier instante, la proporción de partículas que se mueven a una velocidad dada dentro de este rango está determinada por la probabilidad como se describe en la distribución de Maxwell-Boltzmann . El gráfico que se muestra aquí en la Fig. 2 muestra la distribución de velocidad de átomos de helio de 5500 K. Tienen una velocidad más probable de 4.780 km/s (0.2092 s/km). Sin embargo, una cierta proporción de átomos en cualquier instante dado se mueven más rápido mientras que otros se mueven relativamente lento; algunos están momentáneamente en un punto muerto virtual (fuera del eje x a la derecha). Este gráfico utiliza la velocidad inversa para el eje x , por lo que la forma de la curva se puede comparar fácilmente con las curvas de la figura 5 a continuación. En ambos gráficos, el cero en el eje x representa una temperatura infinita. Además, los ejes x e y en ambos gráficos están escalados proporcionalmente.
Aunque se necesitan equipos de laboratorio muy especializados para detectar directamente los movimientos de traslación, las colisiones resultantes de átomos o moléculas con pequeñas partículas suspendidas en un fluido producen un movimiento browniano que se puede ver con un microscopio común. Los movimientos de traslación de partículas elementales son muy rápidos [11] y se requieren temperaturas cercanas al cero absoluto para observarlos directamente. Por ejemplo, cuando los científicos del NIST alcanzaron una temperatura de frío récord de 700 nK (milmillonésimas de kelvin) en 1994, utilizaron un equipo de láser de red óptica para enfriar adiabáticamente átomos de cesio . Luego apagaron los láseres de atrapamiento y midieron directamente velocidades atómicas de 7 mm por segundo para calcular su temperatura. [12] Las fórmulas para calcular la velocidad y la rapidez del movimiento de traslación se dan en la siguiente nota a pie de página. [13]
No es difícil imaginar movimientos atómicos debidos a la temperatura cinética, ni distinguir entre tales movimientos y aquellos debidos a la energía del punto cero. Consideremos el siguiente experimento mental hipotético, como se ilustra en la Fig. 2.5 a la izquierda, con un átomo que está extremadamente cerca del cero absoluto. Imaginemos que miramos a través de un microscopio óptico común ajustado a 400 aumentos, que es aproximadamente el aumento práctico máximo para microscopios ópticos. Dichos microscopios generalmente proporcionan campos de visión de un poco más de 0,4 mm de diámetro. En el centro del campo de visión hay un solo átomo de argón levitando (el argón comprende aproximadamente el 0,93% del aire) que está iluminado y brilla contra un fondo oscuro. Si este átomo de argón estuviera a una billonésima parte de un kelvin por encima del cero absoluto, una temperatura récord [14], y se estuviera moviendo perpendicularmente al campo de visión hacia la derecha, necesitaría 13,9 segundos para moverse desde el centro de la imagen hasta la marca de 200 micrones; Esta distancia de viaje es aproximadamente la misma que la anchura del período al final de esta frase en los monitores de ordenador modernos. A medida que el átomo de argón se mueve lentamente, la vibración posicional debida a la energía del punto cero sería mucho menor que la resolución de 200 nanómetros (0,0002 mm) de un microscopio óptico. Es importante destacar que la velocidad de traslación del átomo de 14,43 micrones por segundo constituye toda su energía cinética retenida debido a que no está precisamente en el cero absoluto. Si el átomo estuviera precisamente en el cero absoluto, un empujón imperceptible debido a la energía del punto cero haría que se desviara muy ligeramente, pero el átomo estaría ubicado perpetuamente, en promedio, en el mismo punto dentro del campo de visión. Esto es análogo a un barco que ha tenido su motor apagado y ahora se balancea ligeramente en aguas oceánicas relativamente tranquilas y sin viento; aunque el barco se desplaza aleatoriamente de un lado a otro, permanece en el mismo lugar a largo plazo y no avanza a través del agua. En consecuencia, un átomo que se encontrara exactamente en el cero absoluto no estaría "inmóvil" y, sin embargo, un conjunto estadísticamente significativo de tales átomos tendría cero energía cinética neta disponible para transferir a cualquier otro conjunto de átomos. Esto se debe a que, independientemente de la temperatura cinética del segundo conjunto de átomos, estos también experimentan los efectos de la energía del punto cero. Tales son las consecuencias de la mecánica estadística y la naturaleza de la termodinámica.

Como se mencionó anteriormente, hay otras formas en que las moléculas pueden moverse además de los tres grados de libertad traslacionales que imbuyen a las sustancias con su temperatura cinética. Como se puede ver en la animación de la derecha, las moléculas son objetos complejos; son una población de átomos y la agitación térmica puede tensar sus enlaces químicos internos de tres formas diferentes: a través de la rotación, la longitud del enlace y los movimientos del ángulo de enlace; todos estos son tipos de grados de libertad internos . Esto hace que las moléculas se distingan de las sustancias monoatómicas (que consisten en átomos individuales) como los gases nobles helio y argón , que solo tienen los tres grados de libertad traslacionales (los ejes X, Y y Z). La energía cinética se almacena en los grados de libertad internos de las moléculas, lo que les da una temperatura interna . Aunque estos movimientos se denominan "internos", las partes externas de las moléculas aún se mueven, de manera similar al movimiento de un globo de agua estacionario . Esto permite el intercambio bidireccional de energía cinética entre los movimientos internos y los movimientos traslacionales con cada colisión molecular. En consecuencia, a medida que se elimina energía interna de las moléculas, tanto su temperatura cinética (la energía cinética del movimiento de traslación) como su temperatura interna disminuyen simultáneamente en proporciones iguales. Este fenómeno se describe mediante el teorema de equipartición , que establece que para cualquier cantidad de una sustancia en equilibrio, la energía cinética del movimiento de partículas se distribuye uniformemente entre todos los grados de libertad activos disponibles para las partículas. Dado que la temperatura interna de las moléculas suele ser igual a su temperatura cinética, la distinción suele ser de interés solo en el estudio detallado de fenómenos de equilibrio termodinámico no local (LTE), como la combustión , la sublimación de sólidos y la difusión de gases calientes en un vacío parcial.
La energía cinética almacenada internamente en las moléculas hace que las sustancias contengan más energía térmica a cualquier temperatura dada y absorban energía interna adicional para un aumento de temperatura dado. Esto se debe a que cualquier energía cinética que, en un instante dado, esté ligada a los movimientos internos, no contribuye a los movimientos de traslación de las moléculas en ese mismo instante. [15] Esta energía cinética adicional simplemente aumenta la cantidad de energía interna que absorbe la sustancia para un aumento de temperatura dado. Esta propiedad se conoce como capacidad calorífica específica de una sustancia .
Diferentes moléculas absorben diferentes cantidades de energía interna por cada incremento incremental de temperatura; es decir, tienen diferentes capacidades caloríficas específicas. Una alta capacidad calorífica específica surge, en parte, porque las moléculas de ciertas sustancias poseen más grados de libertad internos que otras. Por ejemplo, el nitrógeno a temperatura ambiente , que es una molécula diatómica , tiene cinco grados de libertad activos: los tres que comprenden el movimiento de traslación más dos grados de libertad rotacionales internamente. No es sorprendente que, de acuerdo con el teorema de equipartición, el nitrógeno tenga cinco tercios de la capacidad calorífica específica por mol (un número específico de moléculas) que los gases monoatómicos. [16] Otro ejemplo es la gasolina (ver la tabla que muestra su capacidad calorífica específica). La gasolina puede absorber una gran cantidad de energía térmica por mol con solo un cambio de temperatura modesto porque cada molécula comprende un promedio de 21 átomos y, por lo tanto, tiene muchos grados de libertad internos. Incluso moléculas más grandes y complejas pueden tener docenas de grados de libertad internos.

La conducción de calor es la difusión de energía térmica desde las partes calientes de un sistema a las partes frías. Un sistema puede ser una sola entidad en volumen o una pluralidad de entidades en volumen discretas. El término en volumen en este contexto significa una cantidad estadísticamente significativa de partículas (que puede ser una cantidad microscópica). Siempre que la energía térmica se difunde dentro de un sistema aislado, las diferencias de temperatura dentro del sistema disminuyen (y la entropía aumenta).
Un mecanismo particular de conducción de calor ocurre cuando el movimiento de traslación, el movimiento de partículas que subyace a la temperatura, transfiere momento de una partícula a otra en las colisiones. En los gases, estos movimientos de traslación son de la naturaleza que se muestra en la figura 1. Como se puede ver en esa animación, no solo el momento (calor) se difunde por todo el volumen del gas a través de colisiones en serie, sino que moléculas o átomos enteros pueden avanzar hacia un nuevo territorio, llevando consigo su energía cinética. En consecuencia, las diferencias de temperatura se igualan en todos los gases muy rápidamente, especialmente para átomos o moléculas ligeros; la convección acelera este proceso aún más. [17]
Sin embargo, el movimiento traslacional en los sólidos toma la forma de fonones (ver Figura 4 a la derecha). Los fonones son paquetes de ondas cuantificadas y restringidas que viajan a la velocidad del sonido de una sustancia dada. La forma en que los fonones interactúan dentro de un sólido determina una variedad de sus propiedades, incluida su conductividad térmica. En sólidos eléctricamente aislantes, la conducción de calor basada en fonones suele ser ineficiente [18] y dichos sólidos se consideran aislantes térmicos (como el vidrio, el plástico, el caucho, la cerámica y la roca). Esto se debe a que en los sólidos, los átomos y las moléculas están bloqueados en un lugar en relación con sus vecinos y no son libres de moverse.
Sin embargo, los metales no se limitan solo a la conducción de calor basada en fonones. La energía térmica se conduce a través de los metales de manera extraordinariamente rápida porque, en lugar de colisiones directas de molécula a molécula, la gran mayoría de la energía térmica está mediada por electrones de conducción muy ligeros y móviles . Por eso existe una correlación casi perfecta entre la conductividad térmica de los metales y su conductividad eléctrica . [19] Los electrones de conducción imbuyen a los metales con su conductividad extraordinaria porque están deslocalizados (es decir, no están ligados a un átomo específico) y se comportan más bien como una especie de gas cuántico debido a los efectos de la energía del punto cero (para más información sobre ZPE, consulte la Nota 1 a continuación). Además, los electrones son relativamente ligeros con una masa en reposo de solo 1 ⁄ 1836 de la de un protón . Esta es aproximadamente la misma relación que una bala .22 Short (29 granos o 1,88 g ) en comparación con el rifle que la dispara. Como escribió Isaac Newton con su tercera ley del movimiento ,
Ley #3: Todas las fuerzas ocurren en pares, y estas dos fuerzas son iguales en magnitud y opuestas en dirección.
Sin embargo, una bala acelera más rápido que un rifle si se le aplica una fuerza igual. Como la energía cinética aumenta con el cuadrado de la velocidad, casi toda la energía cinética va a la bala, no al rifle, aunque ambos experimenten la misma fuerza de los gases propulsores en expansión. De la misma manera, como tienen mucha menos masa, la energía térmica es fácilmente transportada por los electrones de conducción móviles. Además, como están deslocalizados y son muy rápidos, la energía térmica cinética se conduce extremadamente rápido a través de metales con abundantes electrones de conducción.

La radiación térmica es un subproducto de las colisiones que surgen de varios movimientos vibratorios de los átomos. Estas colisiones hacen que los electrones de los átomos emitan fotones térmicos (conocidos como radiación de cuerpo negro ). Los fotones se emiten cada vez que se acelera una carga eléctrica (como sucede cuando las nubes de electrones de dos átomos chocan). Incluso las moléculas individuales con temperaturas internas mayores que el cero absoluto también emiten radiación de cuerpo negro desde sus átomos. En cualquier cantidad de una sustancia en equilibrio, los fotones de cuerpo negro se emiten a través de un rango de longitudes de onda en un espectro que tiene una forma similar a una curva de campana llamada curva de Planck (ver gráfico en la Fig. 5 a la derecha). La parte superior de una curva de Planck ( la longitud de onda de emisión máxima ) se encuentra en una parte particular del espectro electromagnético dependiendo de la temperatura del cuerpo negro. Las sustancias a temperaturas criogénicas extremas emiten en longitudes de onda de radio largas, mientras que las temperaturas extremadamente altas producen rayos gamma cortos (ver § Tabla de temperaturas termodinámicas).
La radiación de cuerpo negro difunde energía térmica por toda la sustancia a medida que los fotones son absorbidos por los átomos vecinos, transfiriendo momento en el proceso. Los fotones de cuerpo negro también escapan fácilmente de una sustancia y pueden ser absorbidos por el entorno; la energía cinética se pierde en el proceso.
Según la ley de Stefan-Boltzmann , la intensidad de la radiación de un cuerpo negro aumenta con la cuarta potencia de la temperatura absoluta. Por lo tanto, un cuerpo negro a 824 K (apenas por debajo del rojo brillante) emite 60 veces más potencia radiante que a 296 K (temperatura ambiente). Por eso es tan fácil sentir el calor radiante de los objetos calientes a distancia. A temperaturas más altas, como las que se encuentran en una lámpara incandescente , la radiación de un cuerpo negro puede ser el principal mecanismo por el que la energía térmica escapa de un sistema.
La siguiente tabla muestra varios puntos en la escala termodinámica, en orden de aumento de temperatura.

La energía cinética del movimiento de partículas es solo un contribuyente a la energía térmica total en una sustancia; otro son las transiciones de fase , que son la energía potencial de los enlaces moleculares que pueden formarse en una sustancia a medida que se enfría (como durante la condensación y la congelación ). La energía térmica requerida para una transición de fase se llama calor latente . Este fenómeno puede comprenderse más fácilmente considerándolo en la dirección inversa: el calor latente es la energía requerida para romper enlaces químicos (como durante la evaporación y la fusión ). Casi todos están familiarizados con los efectos de las transiciones de fase; por ejemplo, el vapor a 100 °C puede causar quemaduras graves mucho más rápido que el aire a 100 °C de un secador de pelo . Esto ocurre porque se libera una gran cantidad de calor latente a medida que el vapor se condensa en agua líquida sobre la piel.
Aunque la energía térmica se libera o se absorbe durante las transiciones de fase, los elementos químicos puros , los compuestos y las aleaciones eutécticas no muestran ningún cambio de temperatura mientras las experimentan (ver Figura 7 , abajo a la derecha). Consideremos un tipo particular de transición de fase: la fusión. Cuando un sólido se está derritiendo, los enlaces químicos de la red cristalina se están rompiendo; la sustancia está haciendo la transición de lo que se conoce como un estado más ordenado a un estado menos ordenado . En la Figura 7 , la fusión del hielo se muestra dentro del recuadro inferior izquierdo que encabeza el encabezado de azul a verde.
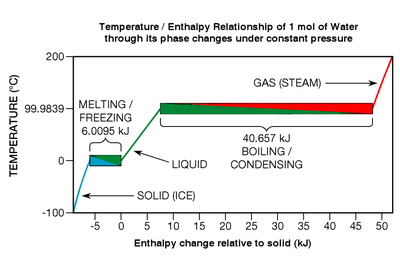
En un punto termodinámico específico, el punto de fusión (que es 0 °C en un amplio rango de presión en el caso del agua), todos los átomos o moléculas están, en promedio, en el umbral máximo de energía que sus enlaces químicos pueden soportar sin romperse de la red. Los enlaces químicos son fuerzas de todo o nada: o se mantienen firmes o se rompen; no hay un estado intermedio. En consecuencia, cuando una sustancia está en su punto de fusión, cada julio de energía térmica agregada solo rompe los enlaces de una cantidad específica de sus átomos o moléculas, [33] convirtiéndolos en un líquido exactamente a la misma temperatura; no se agrega energía cinética al movimiento de traslación (que es lo que le da a las sustancias su temperatura). El efecto es bastante parecido al de las palomitas de maíz : a una cierta temperatura, la energía térmica adicional no puede hacer que los granos se calienten más hasta que se complete la transición (estallido). Si el proceso se invierte (como en la congelación de un líquido), se debe eliminar energía térmica de una sustancia.
Como se indicó anteriormente, la energía térmica requerida para una transición de fase se llama calor latente . En los casos específicos de fusión y congelación, se llama entalpía de fusión o calor de fusión . Si los enlaces moleculares en una red cristalina son fuertes, el calor de fusión puede ser relativamente grande, típicamente en el rango de 6 a 30 kJ por mol para el agua y la mayoría de los elementos metálicos. [34] Si la sustancia es uno de los gases monoatómicos (que tienen poca tendencia a formar enlaces moleculares), el calor de fusión es más modesto, oscilando entre 0,021 y 2,3 kJ por mol. [35] Relativamente hablando, las transiciones de fase pueden ser eventos verdaderamente energéticos. Para fundir completamente el hielo a 0 °C en agua a 0 °C, se debe agregar aproximadamente 80 veces la energía térmica que se requiere para aumentar la temperatura de la misma masa de agua líquida en un grado Celsius. Las proporciones de los metales son incluso mayores, típicamente en el rango de 400 a 1200 veces. [36] La transición de fase de ebullición es mucho más energética que la de congelación. Por ejemplo, la energía necesaria para hervir o vaporizar completamente el agua (lo que se conoce como entalpía de vaporización ) es aproximadamente 540 veces la necesaria para un aumento de un grado. [37]
La considerable entalpía de vaporización del agua es la razón por la que la piel puede quemarse tan rápidamente cuando el vapor se condensa sobre ella (pasando de rojo a verde en la Fig. 7 ); los vapores de agua (fase gaseosa) se licúan en la piel y liberan una gran cantidad de energía (entalpía) al medio ambiente, incluida la piel, lo que provoca daños en la piel. En la dirección opuesta, esta es la razón por la que la piel se siente fría cuando el agua líquida se evapora (un proceso que ocurre a una temperatura de bulbo húmedo subambiente que depende de la humedad relativa ); la evaporación del agua en la piel absorbe una gran cantidad de energía del medio ambiente, incluida la piel, lo que reduce la temperatura de la piel. La entalpía de vaporización altamente energética del agua también es un factor importante que explica por qué las cubiertas solares para piscinas (mantas flotantes y aislantes que cubren las piscinas cuando no están en uso) son tan eficaces para reducir los costos de calefacción: evitan la evaporación. (En otras palabras, la extracción de energía del agua cuando se evapora es limitada). Por ejemplo, la evaporación de sólo 20 mm de agua de una piscina de 1,29 metros de profundidad enfría su agua 8,4 °C (15,1 °F).
La energía total de todos los movimientos de traslación y de partículas internas, incluyendo la de los electrones de conducción, más la energía potencial de los cambios de fase, más la energía del punto cero [5] de una sustancia comprenden la energía interna de la misma.

A medida que una sustancia se enfría, las diferentes formas de energía interna y sus efectos relacionados disminuyen simultáneamente en magnitud: el calor latente de las transiciones de fase disponibles se libera a medida que una sustancia cambia de un estado menos ordenado a un estado más ordenado; los movimientos de traslación de los átomos y las moléculas disminuyen (su energía cinética o temperatura disminuye); los movimientos internos de las moléculas disminuyen (su energía interna o temperatura disminuye); los electrones de conducción (si la sustancia es un conductor eléctrico) viajan algo más lento; [38] y la longitud de onda de emisión máxima de la radiación del cuerpo negro aumenta (la energía de los fotones disminuye). Cuando las partículas de una sustancia están lo más cerca posible del reposo completo y retienen solo el movimiento mecánico cuántico inducido por ZPE (energía de punto cero), la sustancia está a la temperatura del cero absoluto ( T = 0).

Mientras que el cero absoluto es el punto de temperatura termodinámica cero y también es el punto en el que las partículas constituyentes de la materia tienen un movimiento mínimo, el cero absoluto no es necesariamente el punto en el que una sustancia contiene energía interna cero; uno debe ser muy preciso con lo que uno quiere decir con energía interna . A menudo, todos los cambios de fase que pueden ocurrir en una sustancia, habrán ocurrido para cuando alcance el cero absoluto. Sin embargo, este no siempre es el caso. Cabe destacar que T = 0 el helio permanece líquido a presión ambiente ( Fig. 9 a la derecha) y debe estar bajo una presión de al menos 25 bar (2,5 MPa ) para cristalizar. Esto se debe a que el calor de fusión del helio (la energía requerida para fundir el hielo de helio) es tan bajo (solo 21 julios por mol) que el efecto inductor de movimiento de la energía del punto cero es suficiente para evitar que se congele a presiones más bajas.
Otra complicación es que muchos sólidos cambian su estructura cristalina a configuraciones más compactas a presiones extremadamente altas (hasta millones de bares o cientos de gigapascales). Estas se conocen como transiciones de fase sólido-sólido, en las que se libera calor latente a medida que una red cristalina cambia a una más compacta y termodinámicamente favorable.
Las complejidades anteriores hacen que las afirmaciones generales sobre la energía interna en sustancias T = 0 sean bastante engorrosas. Sin embargo, independientemente de la presión, lo que se puede decir es que en el cero absoluto, todos los sólidos con una red cristalina de energía más baja, como aquellos con una disposición más compacta (ver Figura 8 , arriba a la izquierda) contienen una energía interna mínima, reteniendo solo la que se debe al fondo siempre presente de energía de punto cero. [5] [39] También se puede decir que para una sustancia dada a presión constante, el cero absoluto es el punto de entalpía más baja (una medida del potencial de trabajo que tiene en cuenta la energía interna, la presión y el volumen). [40] Por último, todas las sustancias T = 0 contienen energía térmica cinética cero. [5] [13]
La temperatura termodinámica es útil no solo para los científicos, también puede ser útil para los legos en muchas disciplinas que involucran gases. Al expresar las variables en términos absolutos y aplicar la ley de proporcionalidad temperatura/presión de Gay-Lussac , las soluciones a los problemas cotidianos son sencillas; por ejemplo, calcular cómo un cambio de temperatura afecta la presión dentro de un neumático de automóvil. Si el neumático tiene una presión manométrica fría [41] de 200 kPa , entonces su presión absoluta es de 300 kPa. [42] [43] La temperatura ambiente ("fría" en términos de neumáticos) es de 296 K. Si la temperatura del neumático es 20 °C más alta (20 kelvin), la solución se calcula como 316 K/296 mil = 6,8% mayor temperatura termodinámica y presión absoluta; es decir, una presión absoluta de 320 kPa, que es una presión manométrica de 220 kPa.
La temperatura termodinámica está estrechamente vinculada a la ley de los gases ideales y sus consecuencias. También puede vincularse a la segunda ley de la termodinámica. Se puede demostrar que la temperatura termodinámica tiene propiedades especiales y, en particular, se puede ver que está definida de manera única (hasta cierto factor multiplicativo constante) considerando la eficiencia de los motores térmicos idealizados . Por lo tanto, la relación T 2 / T 1 de dos temperaturas T 1 y T 2 es la misma en todas las escalas absolutas.
En sentido estricto, la temperatura de un sistema está bien definida solo si se encuentra en equilibrio térmico . Desde un punto de vista microscópico, un material está en equilibrio térmico si la cantidad de calor entre sus partículas individuales se cancela. Existen muchas escalas posibles de temperatura, derivadas de una variedad de observaciones de fenómenos físicos.
En términos generales, las diferencias de temperatura determinan la dirección del calor entre dos sistemas, de modo que su energía combinada se distribuya de forma máxima entre sus estados más bajos posibles. A esta distribución la llamamos " entropía ". Para entender mejor la relación entre temperatura y entropía, considere la relación entre calor, trabajo y temperatura ilustrada en la máquina térmica de Carnot . La máquina convierte el calor en trabajo dirigiendo un gradiente de temperatura entre una fuente de calor de mayor temperatura, T H , y un disipador de calor de menor temperatura, T C , a través de un pistón lleno de gas. El trabajo realizado por ciclo es igual en magnitud al calor neto absorbido, que es la suma del calor q H absorbido por la máquina de la fuente de alta temperatura, más el calor residual emitido por la máquina, q C < 0. [44] La eficiencia de la máquina es el trabajo dividido por el calor introducido en el sistema o
donde es el trabajo realizado por ciclo. Por lo tanto, la eficiencia depende únicamente de | q C | / | q H | .
El teorema de Carnot establece que todas las máquinas reversibles que funcionan entre los mismos depósitos de calor son igualmente eficientes. Por lo tanto, cualquier máquina térmica reversible que funcione entre las temperaturas T 1 y T 2 debe tener la misma eficiencia, es decir, la eficiencia es función únicamente de las temperaturas
Además, un motor térmico reversible que funciona entre un par de depósitos térmicos a temperaturas T 1 y T 3 debe tener la misma eficiencia que uno que consta de dos ciclos, uno entre T 1 y otra temperatura (intermedia) T 2 , y el segundo entre T 2 y T 3 . Si este no fuera el caso, entonces se desperdiciará o ganará energía (en forma de q ), lo que dará como resultado diferentes eficiencias generales cada vez que un ciclo se divida en ciclos componentes; claramente, un ciclo puede estar compuesto por cualquier número de ciclos más pequeños como una opción de diseño del motor, y cualquier motor reversible entre el mismo depósito en T 1 y T 3 debe ser igualmente eficiente independientemente del diseño del motor.
Si elegimos motores tales que el trabajo realizado por el motor de un ciclo y el motor de dos ciclos sea el mismo, entonces la eficiencia de cada motor térmico se escribe como se muestra a continuación.
Aquí, el motor 1 es el motor de un ciclo, y los motores 2 y 3 forman el motor de dos ciclos donde existe el depósito intermedio en T 2 . También hemos utilizado el hecho de que el calor pasa a través del depósito térmico intermedio en sin perder su energía. (Es decir, no se pierde durante su paso a través del depósito en ). Este hecho puede demostrarse mediante lo siguiente.
Para tener consistencia en la última ecuación, el calor que fluye desde el motor 2 al depósito intermedio debe ser igual al calor que fluye desde el depósito hacia el motor 3.
Con esta comprensión de q 1 , q 2 y q 3 , matemáticamente,
Pero como la primera función no es una función de T 2 , el producto de las dos funciones finales debe dar como resultado la eliminación de T 2 como variable. La única manera es, por lo tanto, definir la función f de la siguiente manera: y de modo que
Es decir, la relación de calor intercambiado es una función de las respectivas temperaturas a las que se producen. Podemos elegir cualquier función monótona para nuestra ; [45] es una cuestión de conveniencia y convención que elijamos . Al elegir entonces una temperatura de referencia fija (es decir, el punto triple del agua), establecemos la escala de temperatura termodinámica.
Esta definición coincide con la de la derivación del gas ideal; también es esta definición de la temperatura termodinámica la que nos permite representar la eficiencia de Carnot en términos de T H y T C , y por lo tanto derivar que el ciclo de Carnot (completo) es isentrópico:
Sustituyendo esto en nuestra primera fórmula de eficiencia obtenemos una relación en términos de temperatura:
Obsérvese que para T C = 0 la eficiencia es del 100% y que la eficiencia se vuelve mayor que el 100% para T C < 0 , lo cual no es realista. Restando 1 del lado derecho de la ecuación (4) y de la parte media se obtiene y, por lo tanto, [46] [44]
La generalización de esta ecuación es el teorema de Clausius , que propone la existencia de una función de estado (es decir, una función que depende sólo del estado del sistema, no de cómo llegó a ese estado) definida (hasta una constante aditiva) por
donde el subíndice rev indica transferencia de calor en un proceso reversible. La función es la entropía del sistema, mencionada anteriormente, y el cambio de alrededor de cualquier ciclo es cero (como es necesario para cualquier función de estado). La ecuación 5 se puede reorganizar para obtener una definición alternativa de temperatura en términos de entropía y calor (para evitar un bucle lógico, primero deberíamos definir la entropía a través de la mecánica estadística):
Para un sistema de volumen constante (por lo tanto, sin trabajo mecánico ) en el que la entropía es una función de su energía interna y , por lo tanto, la temperatura termodinámica está dada por de modo que el recíproco de la temperatura termodinámica es la tasa de cambio de la entropía con respecto a la energía interna a volumen constante.

Guillaume Amontons (1663-1705) publicó dos artículos en 1702 y 1703 que pueden utilizarse para acreditarlo como el primer investigador en deducir la existencia de una escala de temperatura fundamental (termodinámica) que incluye un cero absoluto. Hizo el descubrimiento mientras intentaba mejorar los termómetros de aire que se utilizaban en ese momento. Sus termómetros de tubo en J comprendían una columna de mercurio sostenida por una masa fija de aire atrapada dentro de la parte sensora del termómetro. En términos termodinámicos, sus termómetros se basaban en la relación entre el volumen y la temperatura del gas bajo presión constante. Sus mediciones del punto de ebullición del agua y el punto de fusión del hielo mostraron que, independientemente de la masa de aire atrapada dentro de sus termómetros o del peso del mercurio que soportaba el aire, la reducción del volumen de aire en el punto de hielo siempre era la misma. Esta observación lo llevó a postular que una reducción suficiente de la temperatura reduciría el volumen de aire a cero. De hecho, sus cálculos proyectaban que el cero absoluto equivalía a -240 °C, solo 33,15 grados menos que el valor real de -273,15 °C. El descubrimiento de Amonton de una relación uno a uno entre la temperatura absoluta y la presión absoluta fue redescubierto un siglo después y popularizado dentro de la comunidad científica por Joseph Louis Gay-Lussac . Hoy en día, este principio de la termodinámica se conoce comúnmente como la ley de Gay-Lussac, pero también se conoce como la ley de Amonton .

En 1742, Anders Celsius (1701-1744) creó una versión "inversa" de la escala de temperatura Celsius moderna. En la escala original de Celsius, el cero representaba el punto de ebullición del agua y el 100 representaba el punto de fusión del hielo. En su artículo Observations of two persistent degrees on a thermometer (Observaciones de dos grados persistentes en un termómetro) , relató sus experimentos que demostraban que el punto de fusión del hielo no se veía afectado por la presión. También determinó con notable precisión cómo variaba el punto de ebullición del agua en función de la presión atmosférica. Propuso que el cero en su escala de temperatura (el punto de ebullición del agua) se calibrara con la presión barométrica media al nivel medio del mar.

Coincidiendo con la muerte de Anders Celsius en 1744, el botánico Carl Linnaeus (1707-1778) revirtió efectivamente [47] [48] [ cita completa requerida ] la escala de Celsius al recibir su primer termómetro con una escala donde cero representaba el punto de fusión del hielo y 100 representaba el punto de ebullición del agua. El termómetro de Linnaeus hecho a medida , para usar en sus invernaderos, fue fabricado por Daniel Ekström, el principal fabricante de instrumentos científicos de Suecia en ese momento. Durante los siguientes 204 años, las comunidades científicas y de termometría en todo el mundo se refirieron a esta escala como la escala centígrada . Las temperaturas en la escala centígrada a menudo se informaban simplemente como grados o, cuando se deseaba una mayor especificidad, grados centígrados . El símbolo para los valores de temperatura en esta escala era °C (en varios formatos a lo largo de los años). Como el término centígrado era también el nombre en francés de una unidad de medida angular (la centésima parte de un ángulo recto) y tenía una connotación similar en otros idiomas, se utilizó el término " grado centesimal " cuando los organismos de normalización internacionales, como la Oficina Internacional de Pesas y Medidas (BIPM), exigían un lenguaje muy preciso e inequívoco. La 9.ª CGPM ( Conferencia General de Pesas y Medidas ) y el CIPM ( Comité Internacional de Pesas y Medidas) adoptaron formalmente [49] el grado Celsius (símbolo: °C) en 1948.

En su libro Pyrometrie (1777) [50] , terminado cuatro meses antes de su muerte, Johann Heinrich Lambert (1728-1777), a veces incorrectamente llamado Joseph Lambert, propuso una escala de temperatura absoluta basada en la relación presión/temperatura de un volumen fijo de gas. Esto es distinto de la relación volumen/temperatura del gas bajo presión constante que Guillaume Amontons descubrió 75 años antes. Lambert afirmó que el cero absoluto era el punto en el que una simple extrapolación en línea recta alcanzaba la presión de gas cero y era igual a −270 °C.

A pesar del trabajo de Guillaume Amontons 85 años antes, a Jacques Alexandre César Charles (1746-1823) se le atribuye a menudo el descubrimiento (circa 1787), aunque no su publicación, de que el volumen de un gas bajo presión constante es proporcional a su temperatura absoluta. La fórmula que creó fue V 1 / T 1 = V 2 / T 2 .

Joseph Louis Gay-Lussac (1778-1850) publicó un trabajo en 1802 (reconociendo las notas de laboratorio inéditas de Jacques Charles quince años antes) que describe cómo el volumen de gas bajo presión constante cambia linealmente con su temperatura absoluta (termodinámica). Este comportamiento se denomina ley de Charles y es una de las leyes de los gases . Las suyas son las primeras fórmulas conocidas que utilizan el número 273 para el coeficiente de expansión del gas en relación con el punto de fusión del hielo (lo que indica que el cero absoluto era equivalente a −273 °C).

William Thomson (1824-1907), también conocido como Lord Kelvin, escribió en su artículo de 1848 "Sobre una escala termométrica absoluta" [51] sobre la necesidad de una escala en la que el frío infinito (cero absoluto) fuera el punto cero de la escala y que utilizara el grado Celsius como unidad de incremento. Al igual que Gay-Lussac, Thomson calculó que el cero absoluto era equivalente a -273 °C en los termómetros de aire de la época. Esta escala absoluta se conoce hoy como la escala de temperatura termodinámica de Kelvin. El valor de Thomson de -273 se derivó de 0,00366, que era el coeficiente de expansión aceptado del gas por grado Celsius en relación con el punto de hielo. El inverso de -0,00366 expresado con cinco dígitos significativos es -273,22 °C, que está notablemente cerca del valor real de -273,15 °C.
En el artículo propuso definir la temperatura utilizando máquinas térmicas idealizadas. En detalle, propuso que, dados tres depósitos de calor a temperaturas , si dos máquinas térmicas reversibles ( máquina de Carnot ), una trabajando entre y otra entre , pueden producir la misma cantidad de trabajo mecánico dejando pasar la misma cantidad de calor, entonces defina .
Obsérvese que, al igual que Carnot, Kelvin trabajó bajo el supuesto de que el calor se conserva ("la conversión de calor (o calórico) en efecto mecánico es probablemente imposible"), y si el calor entra en el motor térmico, entonces el calor debe salir. [52]
Kelvin, al darse cuenta, tras los experimentos de Joule, de que el calor no es una cantidad que se conserva sino que es convertible con el trabajo mecánico, modificó su escala en su obra de 1851 An Account of Carnot's Theory of the Motive Power of Heat (Análisis de la teoría de Carnot sobre la potencia motriz del calor) . En esta obra, la definió de la siguiente manera: [53]
Dados dos depósitos de calor y un motor térmico reversible trabajando entre ellos, de modo que si durante un ciclo del motor el calor entra en el motor y sale calor del motor, entonces .
La definición anterior fija las relaciones entre las temperaturas absolutas, pero no fija una escala para la temperatura absoluta. Para la escala, Thomson propuso utilizar el grado Celsius, es decir, el intervalo entre el punto de congelación y el de ebullición del agua.

En 1859, Macquorn Rankine (1820-1872) propuso una escala de temperatura termodinámica similar a la de William Thomson, pero que utilizaba el grado Fahrenheit como unidad de incremento, es decir, el intervalo entre el punto de congelación y el de ebullición del agua. Esta escala absoluta se conoce hoy como escala de temperatura termodinámica de Rankine .

Ludwig Boltzmann (1844-1906) realizó importantes contribuciones a la termodinámica entre 1877 y 1884 gracias a su comprensión del papel que desempeñaban la cinética de partículas y la radiación del cuerpo negro. Su nombre aparece ahora asociado a varias de las fórmulas que se utilizan hoy en día en termodinámica.
Los experimentos de termometría de gases [ ¿quién los realizó? ] cuidadosamente calibrados con respecto al punto de fusión del hielo y al punto de ebullición del agua mostraron en la década de 1930 que el cero absoluto equivalía a -273,15 °C.
La Resolución 3 [54] de la IX Conferencia General de Pesas y Medidas (CGPM) de 1948 fijó el punto triple del agua exactamente en 0,01 °C. En ese momento, el punto triple aún no tenía una definición formal para su valor kelvin equivalente, que la resolución declaró "será fijado en una fecha posterior". La implicación es que si el valor del cero absoluto medido en la década de 1930 era realmente −273,15 °C, entonces el punto triple del agua (0,01 °C) era equivalente a 273,16 K. Además, tanto el Comité Internacional de Pesas y Medidas (CIPM) como la CGPM adoptaron formalmente [55] el nombre Celsius para el grado Celsius y la escala de temperatura Celsius . [58]
La Resolución 3 [59] de la 10ª CGPM de 1954 dio a la escala kelvin su definición moderna al elegir el punto triple del agua como su punto de definición superior (sin cambios en el cero absoluto, que es el punto nulo) y asignarle una temperatura de exactamente 273,16 kelvin (lo que en realidad se escribía 273,16 grados Kelvin en ese momento). Esto, en combinación con la Resolución 3 de la 9ª CGPM, tuvo el efecto de definir el cero absoluto como exactamente cero kelvin y -273,15 °C.
La Resolución 3 [60] de la 13ª CGPM de 1967/1968 cambió el nombre de la unidad de incremento de temperatura termodinámica por el de kelvin , símbolo K, en sustitución del de grado absoluto , símbolo °K. Además, considerando útil definir más explícitamente la magnitud del incremento de la unidad, la 13ª CGPM decidió también en la Resolución 4 [61] que "El kelvin, unidad de temperatura termodinámica, es la fracción 1/273,16 de la temperatura termodinámica del punto triple del agua".
El CIPM afirmó en 2005 [62] que a los efectos de delinear la temperatura del punto triple del agua, la definición de la escala de temperatura termodinámica Kelvin se referiría al agua que tiene una composición isotópica definida como exactamente igual a la especificación nominal del Agua Media del Océano Estándar de Viena .
En noviembre de 2018, la 26ª Conferencia General de Pesas y Medidas (CGPM) cambió la definición del Kelvin fijando la constante de Boltzmann en1,380 649 × 10 −23 cuando se expresa en la unidad J/K. Este cambio (y otros cambios en la definición de las unidades del SI) entró en vigor el 144.º aniversario de la Convención del Metro, el 20 de mayo de 2019.

Although absolute zero (T = 0) is not a state of zero molecular motion, it is the point of zero temperature and, in accordance with the Boltzmann constant, is also the point of zero particle kinetic energy and zero kinetic velocity. To understand how atoms can have zero kinetic velocity and simultaneously be vibrating due to ZPE, consider the following thought experiment: two T = 0 helium atoms in zero gravity are carefully positioned and observed to have an average separation of 620 pm between them (a gap of ten atomic diameters). It is an "average" separation because ZPE causes them to jostle about their fixed positions. Then one atom is given a kinetic kick of precisely 83 yoctokelvins (1 yK = 1×10−24 K). This is done in a way that directs this atom's velocity vector at the other atom. With 83 yK of kinetic energy between them, the 620 pm gap through their common barycenter would close at a rate of 719 pm/s and they would collide after 0.862 second. This is the same speed as shown in the Fig. 1 animation above. Before being given the kinetic kick, both T = 0 atoms had zero kinetic energy and zero kinetic velocity because they could persist indefinitely in that state and relative orientation even though both were being jostled by ZPE. At T = 0, no kinetic energy is available for transfer to other systems.
Note too that absolute zero serves as the baseline atop which thermodynamics and its equations are founded because they deal with the exchange of thermal energy between "systems" (a plurality of particles and fields modeled as an average). Accordingly, one may examine ZPE-induced particle motion within a system that is at absolute zero but there can never be a net outflow of thermal energy from such a system. Also, the peak emittance wavelength of black-body radiation shifts to infinity at absolute zero; indeed, a peak no longer exists and black-body photons can no longer escape. Because of ZPE, however, virtual photons are still emitted at T = 0. Such photons are called "virtual" because they can't be intercepted and observed. Furthermore, this zero-point radiation has a unique zero-point spectrum. However, even though a T = 0 system emits zero-point radiation, no net heat flow Q out of such a system can occur because if the surrounding environment is at a temperature greater than T = 0, heat will flow inward, and if the surrounding environment is at 'T = 0, there will be an equal flux of ZP radiation both inward and outward. A similar Q equilibrium exists at T = 0 with the ZPE-induced spontaneous emission of photons (which is more properly called a stimulated emission in this context). The graph at upper right illustrates the relationship of absolute zero to zero-point energy. The graph also helps in the understanding of how zero-point energy got its name: it is the vibrational energy matter retains at the zero-kelvin point. Derivation of the classical electromagnetic zero-point radiation spectrum via a classical thermodynamic operation involving van der Waals forces, Daniel C. Cole, Physical Review A, 42 (1990) 1847.
While the details of this process are currently unknown, it must involve a fireball of relativistic particles heated to something in the region of a trillion kelvin.
eq.(64)
{{cite book}}: CS1 maint: location missing publisher (link)