En química orgánica , una halogenación aromática electrofílica es un tipo de sustitución aromática electrofílica . Esta reacción orgánica es típica de los compuestos aromáticos y un método muy útil para añadir sustituyentes a un sistema aromático.
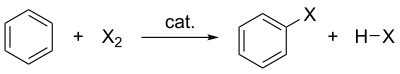
Algunos tipos de compuestos aromáticos, como el fenol , reaccionan sin un catalizador , pero para los derivados típicos del benceno con sustratos menos reactivos, se requiere un ácido de Lewis como catalizador . Los catalizadores típicos de ácido de Lewis incluyen AlCl 3 , FeCl 3 , FeBr 3 y ZnCl 2 . Estos funcionan formando un complejo altamente electrofílico que es atacado por el anillo de benceno.
El mecanismo de reacción para la cloración del benceno es el mismo que el de la bromación del benceno. El bromuro de hierro (III) y el cloruro de hierro (III) se inactivan si reaccionan con el agua, incluida la humedad del aire. Por lo tanto, se generan añadiendo limaduras de hierro al bromo o al cloro. A continuación, se muestra el mecanismo de esta reacción:
El mecanismo de yodación es ligeramente diferente: el yodo (I 2 ) se trata con un agente oxidante como el ácido nítrico para obtener el yodo electrófilo ("I + ", probablemente IONO 2 ). Otras condiciones para la yodación incluyen I 2 , HIO 3 , H 2 SO 4 y N -yodosuccinimida, H 2 SO 4 . [1] [2] Estas condiciones son exitosas para arenos altamente desactivados, incluidos los nitroaromáticos.
En una serie de estudios se utilizó el potente reactivo obtenido mediante el uso de una mezcla de yodo y yodato de potasio disuelto en ácido sulfúrico concentrado. Aquí el agente de yodación es el catión triyodo I 3 + y la base es HSO 4 − . En estos estudios se investigaron tanto la cinética de la reacción como las condiciones preparativas para la yodación de compuestos fuertemente desactivados, como el ácido benzoico y el 3-nitrobenzotrifluoruro. [3] [4]
Si bien la fluoración electrofílica es posible con F 2 /N 2 (10 %), XeF 2 o reactivos NF como Selectfluor , estos métodos rara vez se utilizan debido a la formación de mezclas isoméricas y productos de polifluoración. [5] Aunque también se forman mezclas en el caso de otras halogenaciones aromáticas, los fluoroaromáticos suelen ser extremadamente difíciles de separar de sus contrapartes no fluoradas, polifluoradas y/o isoméricas.
El paso inicial de la halogenación de compuestos aromáticos difiere del de la halogenación de alquenos en que los alquenos no requieren un catalizador para mejorar la electrofilia del halógeno. La formación del ion arenio da como resultado la pérdida temporal de aromaticidad , que tiene una energía de activación más alta en comparación con la formación del ion halonio en los alquenos. En otras palabras, los alquenos son más reactivos y no necesitan que se debilite el enlace Br–Br o Cl–Cl.
Si el anillo contiene un sustituyente fuertemente activador como –OH, –OR o aminas , no es necesario un catalizador, por ejemplo en la bromación de p -cresol : [6]
Sin embargo, si se utiliza un catalizador con exceso de bromo, se formará un tribromuro.
La halogenación de fenoles es más rápida en disolventes polares en un entorno básico debido a la disociación del fenol, siendo los iones fenóxido más susceptibles al ataque electrofílico ya que son más ricos en electrones.
La cloración del tolueno con cloro sin catalizador requiere también un disolvente polar, como el ácido acético . La selectividad orto a para es baja: [7]
No se produce reacción cuando el disolvente se sustituye por tetraclorometano . Por el contrario, cuando el reactivo es 2-feniletilamina , es posible emplear disolventes relativamente apolares con orto- regioselectividad exclusiva debido a la formación intermedia de una cloramina , lo que permite la reacción intramolecular .
El colorante alimentario eritrosina se puede sintetizar mediante la yodación de otro colorante llamado fluoresceína :
Esta reacción es impulsada por el bicarbonato de sodio . [8]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )