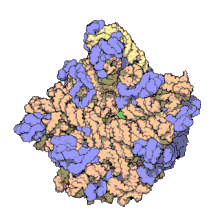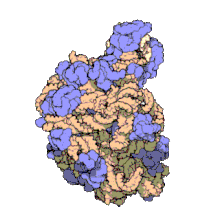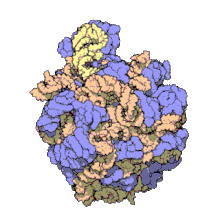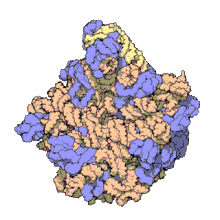
50 S es la subunidad más grande del ribosoma 70S de los procariotas , es decir, bacterias y arqueas . Es el sitio de inhibición de antibióticos como los macrólidos , el cloranfenicol , la clindamicina y las pleuromutilinas . Incluye el ARN ribosómico 5S y el ARN ribosómico 23S .
A pesar de tener la misma velocidad de sedimentación, los ribosomas bacterianos y arqueológicos pueden ser bastante diferentes.
La subunidad 50S, que equivale aproximadamente a la subunidad ribosómica 60S en las células eucariotas , es la subunidad más grande del ribosoma 70S de los procariotas. La subunidad 50S está compuesta principalmente de proteínas, pero también contiene ARN monocatenario conocido como ARN ribosómico (ARNr). El ARNr forma estructuras secundarias y terciarias para mantener la estructura y llevar a cabo las funciones catalíticas del ribosoma.
La cristalografía de rayos X ha producido mapas de densidad electrónica que permiten determinar la estructura del 50S en Haloarcula marismortui (arquea) con una resolución de 2,4 Å [1] y del 50S en Deinococcus radiodurans (bacteria) con una resolución de 3,3 Å. [2] La subunidad ribosómica grande (50S) es aproximadamente el doble de masiva que la subunidad ribosómica pequeña ( 30S ). El modelo de Hm 50S, determinado en 2000 por Nenad Ban y colegas en el laboratorio de Thomas Steitz y el laboratorio de Peter Moore , incluye 2711 de los 2923 nucleótidos del ARNr 23S , los 122 nucleótidos de su ARNr 5S y la estructura de 27 de sus 31 proteínas . [1]
La estructura secundaria del 23S se divide en seis grandes dominios, dentro de los cuales el dominio V es el más importante en su actividad de peptidil transferasa [3] . Cada dominio contiene una estructura secundaria normal (por ejemplo, triple de base, tetraloop, pila de purina de cadena cruzada) y también es altamente simétrico en la estructura terciaria; las proteínas intervienen entre sus hélices. A nivel de estructura terciaria , la subunidad grande del ARNr es un solo dominio gigantesco mientras que la subunidad pequeña contiene tres dominios estructurales. Esta diferencia refleja la menor flexibilidad de la subunidad grande requerida por su función. Si bien su núcleo se conserva, acomoda segmentos de expansión en su periferia. [4] [5]
Se ha determinado una estructura crioEM de la subunidad 50S de la arqueona Methanothermobacter thermautotrophicus . Comparte el tamaño/velocidad de sedimentación de la subunidad 50S y el recuento de dos ARNr, pero sus segmentos de expansión 23S tienen más en común con los eucariotas. [6]
Se encuentra disponible una reconstrucción crioEM de la subunidad 50S nativa de la extremadamente halófila arqueana Halococcus morrhuae (clasificada en Euryarchaeota ; grupo Stenosarchaea). La subunidad 50S contiene una inserción de 108 nucleótidos en su ARNr 5S [7] , que con una resolución subnanométrica, se observa que emerge de una unión de cuatro vías sin afectar la estructura canónica del ARNr 5S parental. [4]
Debido a las diferencias, los 50S arqueológicos son menos sensibles a algunos antibióticos que atacan al 50S bacteriano. [8] [9]
50S incluye la actividad que cataliza la formación de enlaces peptídicos (reacción de transferencia de peptidilo), previene la hidrólisis prematura de polipéptidos, proporciona un sitio de unión para los factores de proteína G (ayuda a la iniciación , elongación y terminación) y ayuda al plegamiento de proteínas después de la síntesis.
Se ha revelado un mecanismo de ajuste inducido que explica cómo el 50S cataliza la reacción de transferencia de peptidilos y evita la hidrólisis de los mismos. El grupo amino de un ARNt aminoacilado (se une al sitio A) ataca al carbono de un grupo carbonilo de un ARNt peptidilado (se une al sitio P) y finalmente produce un péptido extendido por un aminoácido esterificado al sitio A, el ARNt unido al sitio A ribosómico y un ARNt desacilado en el sitio P.
Cuando el sitio A está desocupado, el nucleótido U2620 (E. coli U2585), A2486 (2451) y C2106 (2063) intercalan el grupo carbonilo en el medio, forzándolo a una orientación orientada hacia el sitio A. Esta orientación evita cualquier ataque nucleofílico desde el sitio A porque el ángulo de ataque óptimo es de 105 grados desde el plano del grupo éster . Cuando un ARNt con una secuencia CCA completa en su tallo aceptor se une al sitio A, C74 del ARNt apilado con U2590 (2555) induce un cambio conformacional en el ribosoma, lo que resulta en el movimiento de U2541 (2506), U2620 (2585) a través de G2618 (2583). El desplazamiento de bases permite que el grupo éster adopte una nueva conformación accesible al ataque nucleofílico desde el sitio A.
El N3 ( nitrógeno ) de A2486 (2451) es el más cercano al enlace peptídico que se está sintetizando y puede funcionar como una base general para facilitar el ataque nucleofílico por el grupo amino del aminoacil-ARNt (en el sitio A). El pKa de A2486 (2451) es aproximadamente 5 unidades más alto para formar un enlace de hidrógeno con el grupo amino, aumentando así su nucleofilia. La elevación del pKa se logra a través de un mecanismo de retransmisión de carga. A2486 (2451) interactúa con G2482 (G2447), que forma un enlace de hidrógeno con el fosfato enterrado de A2486 (2450). Este fosfato enterrado puede estabilizar los tautómeros imino normalmente raros de ambas bases, lo que resulta en un aumento en la densidad de carga negativa en N3.
Después de la iniciación, elongación y terminación, hay un cuarto paso de desmontaje del complejo post-terminación de ribosoma, ARNm y ARNt, que es un prerrequisito para la siguiente ronda de síntesis de proteínas. La subunidad ribosomal grande tiene un papel en el plegamiento de proteínas tanto in vitro como in vivo . La subunidad ribosomal grande proporciona una superficie hidrofóbica para el paso de colapso hidrofóbico del plegamiento de proteínas. La proteína recién sintetizada necesita acceso completo a la subunidad grande para plegarse; este proceso puede tomar un período de tiempo (5 minutos para la beta-galactosidasa [ cita requerida ] ).
Las haloarqueas utilizadas en el estudio actual fueron resistentes al ácido nalidíxico, estreptomicina, gentamicina, tetraciclina, eritromicina, cloranfenicol, cefalotina y clindamicina.