
En química , la simetría molecular describe la simetría presente en las moléculas y la clasificación de estas moléculas según su simetría. La simetría molecular es un concepto fundamental en química, ya que puede usarse para predecir o explicar muchas de las propiedades químicas de una molécula , como si tiene o no un momento dipolar , así como sus transiciones espectroscópicas permitidas . Para ello es necesario utilizar la teoría de grupos . Esto implica clasificar los estados de la molécula utilizando las representaciones irreducibles de la tabla de caracteres del grupo de simetría de la molécula. La simetría es útil en el estudio de orbitales moleculares , con aplicaciones al método de Hückel , a la teoría de campos de ligandos y a las reglas de Woodward-Hoffmann . Muchos libros de texto de nivel universitario sobre química física , química cuántica , espectroscopia y química inorgánica analizan la simetría. [1] [2] [3] [4] [5] [6] Otro marco a mayor escala es el uso de sistemas cristalinos para describir la simetría cristalográfica en materiales a granel.
Existen muchas técnicas para determinar la simetría de una molécula determinada, incluida la cristalografía de rayos X y diversas formas de espectroscopia . La notación espectroscópica se basa en consideraciones de simetría.
La simetría de grupo puntual de una molécula se define por la presencia o ausencia de 5 tipos de elementos de simetría .

Los cinco elementos de simetría tienen asociados cinco tipos de operaciones de simetría , que dejan la geometría de la molécula indistinguible de la geometría inicial. A veces se distinguen de los elementos de simetría por un signo de intercalación o circunflejo . Así, Ĉ n es la rotación de una molécula alrededor de un eje y Ê es la operación de identidad. Un elemento de simetría puede tener más de una operación de simetría asociada. Por ejemplo, el eje C 4 de la molécula cuadrada de tetrafluoruro de xenón (XeF 4 ) está asociado con dos rotaciones Ĉ 4 en direcciones opuestas (90° y 270°), una rotación Ĉ 2 (180°) y Ĉ 1 (0° o 360°). Debido a que Ĉ 1 es equivalente a Ê , Ŝ 1 a σ y Ŝ 2 a î , todas las operaciones de simetría se pueden clasificar como rotaciones propias o impropias.
Para moléculas lineales, la rotación en sentido horario o antihorario alrededor del eje molecular en cualquier ángulo Φ es una operación de simetría.


Las operaciones de simetría de una molécula (u otro objeto) forman un grupo . En matemáticas, un grupo es un conjunto con una operación binaria que satisface las cuatro propiedades que se enumeran a continuación.
En un grupo de simetría , los elementos del grupo son las operaciones de simetría (no los elementos de simetría), y la combinación binaria consiste en aplicar primero una operación de simetría y luego la otra. Un ejemplo es la secuencia de una rotación C 4 alrededor del eje z y una reflexión en el plano xy, denotada σ(xy) C 4 . Por convención el orden de las operaciones es de derecha a izquierda.
Un grupo de simetría obedece a las propiedades definitorias de cualquier grupo.
El orden de un grupo es el número de elementos del grupo. Para grupos de pedidos pequeños, las propiedades del grupo se pueden verificar fácilmente considerando su tabla de composición, una tabla cuyas filas y columnas corresponden a elementos del grupo y cuyas entradas corresponden a sus productos.

La aplicación (o composición ) sucesiva de una o más operaciones de simetría de una molécula tiene un efecto equivalente al de alguna única operación de simetría de la molécula. Por ejemplo, una rotación C 2 seguida de una reflexión σ v se considera una operación de simetría σ v ': σ v * C 2 = σ v '. ("La operación A seguida de B para formar C " se escribe BA = C ). [9] Además, el conjunto de todas las operaciones de simetría (incluida esta operación de composición) obedece a todas las propiedades de un grupo, dadas anteriormente. Entonces ( S , * ) es un grupo, donde S es el conjunto de todas las operaciones de simetría de alguna molécula y * denota la composición (aplicación repetida) de las operaciones de simetría.
Este grupo se llama grupo de puntos de esa molécula, porque el conjunto de operaciones de simetría deja al menos un punto fijo (aunque para algunas simetrías un eje completo o un plano completo permanece fijo). En otras palabras, un grupo de puntos es un grupo que resume todas las operaciones de simetría que tienen todas las moléculas de esa categoría. [9] La simetría de un cristal, por el contrario, se describe mediante un grupo espacial de operaciones de simetría, que incluye traslaciones en el espacio.
Se pueden determinar las operaciones de simetría del grupo de puntos de una molécula particular considerando la simetría geométrica de su modelo molecular. Sin embargo, cuando se utiliza un grupo de puntos para clasificar estados moleculares, las operaciones en él no deben interpretarse de la misma manera. En cambio, las operaciones se interpretan como rotación y/o reflexión de las coordenadas vibrónicas (vibración electrónica) [10] y estas operaciones conmutan con el hamiltoniano vibrónico. Son "operaciones de simetría" para ese hamiltoniano vibrónico. El grupo de puntos se utiliza para clasificar por simetría los estados propios vibrónicos de una molécula rígida. La clasificación de simetría de los niveles rotacionales, los estados propios del hamiltoniano completo (rotación-vibración-electrónica), requiere el uso del grupo de permutación-inversión apropiado introducido por Longuet-Higgins . [11] Los grupos de puntos describen la simetría geométrica de una molécula, mientras que los grupos de permutación-inversión describen la simetría invariante de energía.
Asignar a cada molécula un grupo de puntos clasifica las moléculas en categorías con propiedades de simetría similares. Por ejemplo, PCl 3 , POF 3 , XeO 3 y NH 3 comparten operaciones de simetría idénticas. [12] Todos ellos pueden someterse a la operación de identidad E , dos operaciones de rotación C 3 diferentes y tres reflexiones en el plano σ v diferentes sin alterar sus identidades, por lo que se colocan en un grupo de puntos, C 3v , con orden 6. [9] De manera similar, el agua (H 2 O) y el sulfuro de hidrógeno (H 2 S) también comparten operaciones de simetría idénticas. Ambos se someten a la operación de identidad E , una rotación C 2 y dos reflexiones σ v sin alterar sus identidades, por lo que ambos se colocan en un grupo de puntos, C 2v , con orden 4. [13] Este sistema de clasificación ayuda a los científicos a estudiar moléculas de manera más eficiente, ya que las moléculas químicamente relacionadas en el mismo grupo de puntos tienden a exhibir esquemas de enlace, diagramas de enlaces moleculares y propiedades espectroscópicas similares. [9] La simetría de grupo de puntos describe la simetría de una molécula cuando se fija en su configuración de equilibrio en un estado electrónico particular. No permite la formación de túneles entre mínimos ni el cambio de forma que puede producirse por los efectos de distorsión centrífuga de la rotación molecular.
La siguiente tabla enumera muchos de los grupos de puntos aplicables a las moléculas, etiquetados utilizando la notación de Schoenflies , que es común en química y espectroscopia molecular. Las descripciones incluyen formas comunes de moléculas, que pueden explicarse mediante el modelo VSEPR . En cada fila, las descripciones y ejemplos no tienen simetrías superiores, lo que significa que el grupo de puntos nombrado captura todas las simetrías de puntos.
Un conjunto de matrices que se multiplican de una manera que imita la tabla de multiplicar de los elementos de un grupo se llama representación del grupo. Por ejemplo, para el grupo de puntos C 2v , las tres matrices siguientes forman parte de una representación del grupo:
Aunque existe un número infinito de tales representaciones, las representaciones irreducibles (o "irreps") del grupo son todo lo que se necesita, ya que todas las demás representaciones del grupo pueden describirse como una suma directa de las representaciones irreducibles. Además, las representaciones irreductibles son aquellas representaciones matriciales en las que las matrices están en su forma más diagonal posible.

Para cualquier grupo, su tabla de caracteres proporciona una tabulación (para las clases del grupo) de los caracteres (la suma de los elementos diagonales) de las matrices de todas las representaciones irreducibles del grupo. Como el número de representaciones irreducibles es igual al número de clases, la tabla de caracteres es cuadrada.
Las representaciones están etiquetadas según un conjunto de convenciones:
Las tablas también capturan información sobre cómo los vectores de base cartesiana, sus rotaciones y sus funciones cuadráticas se transforman mediante las operaciones de simetría del grupo, al observar qué representación irreducible se transforma de la misma manera. Estas indicaciones se encuentran convencionalmente en el lado derecho de las tablas. Esta información es útil porque los orbitales químicamente importantes (en particular los orbitales p y d ) tienen las mismas simetrías que estas entidades.
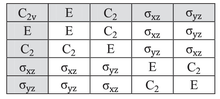
La tabla de caracteres para el grupo de puntos de simetría C 2v se proporciona a continuación:
Considere el ejemplo del agua (H 2 O), que tiene la simetría C 2v descrita anteriormente. El orbital 2 p x del oxígeno tiene simetría B 1 como en la cuarta fila de la tabla de caracteres anterior, con x en la sexta columna). Está orientado perpendicular al plano de la molécula y cambia de signo con una operación C 2 y una σ v '(yz), pero permanece sin cambios con las otras dos operaciones (obviamente, el carácter para la operación de identidad es siempre +1). El conjunto de caracteres de este orbital es, por tanto, {1, −1, 1, −1}, correspondiente a la representación irreducible de B 1 . Asimismo, se ve que el orbital 2 p z tiene la simetría de la representación irreducible A 1 ( es decir , ninguna de las operaciones de simetría la cambia), 2 p y B 2 y el orbital 3 d xy A 2 . Estas asignaciones y otras se indican en las dos columnas más a la derecha de la tabla.
Hans Bethe utilizó caracteres de operaciones de grupos puntuales en su estudio de la teoría del campo de ligandos en 1929, y Eugene Wigner utilizó la teoría de grupos para explicar las reglas de selección de la espectroscopia atómica . [16] Las primeras tablas de caracteres fueron compiladas por László Tisza (1933), en relación con los espectros vibratorios. Robert Mulliken fue el primero en publicar tablas de caracteres en inglés (1933), y E. Bright Wilson las utilizó en 1934 para predecir la simetría de los modos vibracionales normales . [17] El conjunto completo de 32 grupos de puntos cristalográficos fue publicado en 1936 por Rosenthal y Murphy. [18]
Cada modo normal de vibración molecular tiene una simetría que forma la base de una representación irreducible del grupo de simetría molecular. [19] Por ejemplo, la molécula de agua tiene tres modos normales de vibración: estiramiento simétrico en el que las dos longitudes de enlace OH varían en fase entre sí, estiramiento asimétrico en el que varían fuera de fase y flexión en el que varía el ángulo del enlace. . La simetría molecular del agua es C 2v con cuatro representaciones irreducibles A 1 , A 2 , B 1 y B 2 . Los modos de estiramiento simétrico y flexión tienen simetría A 1 , mientras que el modo asimétrico tiene simetría B 2 . Por lo tanto, la simetría general de los tres modos vibratorios es Γ vib = 2A 1 + B 2 . [19] [20]
La simetría molecular del amoníaco es C 3v . El número de modos de vibración se puede encontrar utilizando la fórmula 3N-6 para moléculas no lineales. Por eso tiene seis modos de vibración. Tiene operaciones de simetría E, C 3 y σ v . [7] El movimiento del átomo de nitrógeno y los tres átomos de hidrógeno entre sí dan origen a estos modos. Los tres átomos de hidrógeno viajan simétricamente a lo largo del eje de la molécula, ya sea en la dirección del átomo de nitrógeno o alejándose de él. Este modo se conoce como estiramiento simétrico (v₁). La simetría en el estiramiento del enlace NH se refleja en este movimiento de estiramiento. De los tres modos vibratorios, éste tiene la frecuencia más alta . [21]

En la configuración de flexión (ν₂), el átomo de nitrógeno permanece quieto mientras los tres átomos de hidrógeno se mueven en direcciones diferentes entre sí. Los cambios en los ángulos de enlace resultan de esta acción, que incluye que la molécula se doble fuera del plano. Debido a cómo los átomos de hidrógeno se mueven como un paraguas, este modo a menudo se denomina "modo paraguas". [23] El estiramiento asimétrico (ν₃) también se denomina modo de estiramiento asimétrico. Mientras un átomo se acerca al átomo de nitrógeno , dos átomos de hidrógeno se separan en este modo.
El amoníaco tiene cuatro átomos. Cada átomo está asociado a tres vectores . NH 3 tiene tres representaciones irreducibles A 1 , A 2 y E. Los modos totales de vibración incluyen los modos vibratorio, rotacional y traslacional.
Modos totales = 3A 1 + A 2 + 4E
Modos de rotación = A 2 + E
Modos de traslación = A 1 + E
Modos vibratorios = Modos totales - Modos rotacionales - Modos traslacionales = 3A 1 + A 2 + 4E - A 2 - E - A 1 - E = 2A 1 + 2E
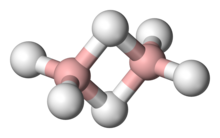
Cada orbital molecular también tiene la simetría de una representación irreducible. Por ejemplo, el etileno (C 2 H 4 ) tiene un grupo de simetría D 2h , y su orbital molecular ocupado más alto ( HOMO ) es el orbital pi de enlace que forma la base de su representación irreducible B 1u . [24]
Como se analizó anteriormente en la sección Grupos de puntos y grupos de permutación-inversión, los grupos de puntos son útiles para clasificar los estados vibratorios y electrónicos de moléculas rígidas (a veces llamadas moléculas semirrígidas ) que experimentan solo pequeñas oscilaciones alrededor de una única geometría de equilibrio. Longuet-Higgins introdujo un tipo más general de grupo de simetría [11] adecuado no sólo para clasificar los estados vibratorios y electrónicos de moléculas rígidas sino también para clasificar sus estados rotacionales y de espín nuclear. Además, estos grupos se pueden utilizar para clasificar los estados de moléculas no rígidas (o fluxionales ) que hacen túneles entre geometrías equivalentes (llamadas versiones [25] ) y para permitir los efectos distorsionantes de la rotación molecular. Estos grupos se conocen como grupos de permutación-inversión , porque las operaciones de simetría en ellos son permutaciones energéticamente factibles de núcleos idénticos, o inversión con respecto al centro de masa (la operación de paridad ), o una combinación de ambas.
Por ejemplo, el etano (C 2 H 6 ) tiene tres conformaciones escalonadas equivalentes . La formación de túneles entre las conformaciones se produce a temperaturas ordinarias mediante la rotación interna de un grupo metilo con respecto al otro. Esta no es una rotación de toda la molécula alrededor del eje C 3 . Aunque cada conformación tiene simetría D 3d , como en la tabla anterior, la descripción de la rotación interna y los estados cuánticos y niveles de energía asociados requiere el grupo de permutación-inversión más completo G 36 . [26]
De manera similar, el amoníaco (NH 3 ) tiene dos conformaciones piramidales equivalentes ( C 3v ) que se interconvierten mediante el proceso conocido como inversión de nitrógeno . Ésta no es la operación de inversión de grupo de puntos que utilicé para moléculas rígidas centrosimétricas (es decir, la inversión de desplazamientos vibratorios y coordenadas electrónicas en el centro de masa nuclear), ya que el NH 3 no tiene centro de inversión y no es centrosimétrico. Más bien, es la inversión de las coordenadas nucleares y electrónicas en el centro de masa molecular (a veces llamada operación de paridad), lo que resulta ser energéticamente factible para esta molécula. El grupo de permutación-inversión apropiado que se utilizará en esta situación es D 3h (M) [27], que es isomorfo con el grupo de puntos D 3h .
Además, como ejemplos, las moléculas de metano (CH 4 ) y H 3 + tienen estructuras de equilibrio altamente simétricas con simetrías de grupos de puntos T d y D 3h respectivamente; Carecen de momentos dipolares eléctricos permanentes pero tienen espectros de rotación pura muy débiles debido a la distorsión centrífuga rotacional. [28] [29] Los grupos de permutación-inversión necesarios para el estudio completo de CH 4 y H 3 + son T d (M) [30] y D 3h (M), respectivamente.
En su estado electrónico fundamental (N), la molécula de etileno C 2 H 4 tiene simetría de grupo de puntos D 2h , mientras que en el estado excitado (V) tiene simetría D 2d . Para tratar estos dos estados juntos es necesario permitir la torsión y utilizar el grupo doble del grupo de permutación-inversión G 16 . [31]
Un segundo enfoque, menos general, de la simetría de moléculas no rígidas se debe a Altmann. [32] [33] En este enfoque, los grupos de simetría se conocen como supergrupos de Schrödinger y constan de dos tipos de operaciones (y sus combinaciones): (1) las operaciones de simetría geométrica (rotaciones, reflexiones, inversiones) de moléculas rígidas, y ( 2) operaciones isodinámicas , que llevan una molécula no rígida a una forma energéticamente equivalente mediante un proceso físicamente razonable, como la rotación alrededor de un enlace simple (como en el etano) o una inversión molecular (como en el amoníaco). [33]
Cada modo normal de vibración formará una base para una representación irreductible del grupo de puntos de la molécula.