La eliminación reductora es un paso elemental en la química organometálica en el que el estado de oxidación del centro metálico disminuye mientras se forma un nuevo enlace covalente entre dos ligandos . Es el reverso microscópico de la adición oxidativa y, a menudo, es el paso de formación del producto en muchos procesos catalíticos. Dado que la adición oxidativa y la eliminación reductora son reacciones inversas, se aplican los mismos mecanismos para ambos procesos y el equilibrio del producto depende de la termodinámica de ambas direcciones. [1] [2]
La eliminación reductiva se observa a menudo en estados de oxidación más altos y puede implicar un cambio de dos electrones en un solo centro metálico (mononuclear) o un cambio de un electrón en cada uno de los dos centros metálicos (binuclear, dinuclear o bimetálico). [1] [2]
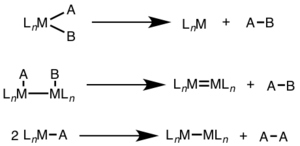
En la eliminación reductiva mononuclear, el estado de oxidación del metal disminuye en dos, mientras que el recuento de electrones d del metal aumenta en dos. Esta vía es común para los metales d8 Ni (II), Pd(II) y Au(III) y los metales d6 Pt(IV), Pd(IV), Ir(III) y Rh(III). Además, la eliminación reductiva mononuclear requiere que los grupos que se eliminan sean cis entre sí en el centro del metal. [3]

En la eliminación reductiva binuclear, el estado de oxidación de cada metal disminuye en uno, mientras que el recuento de electrones d de cada metal aumenta en uno. Este tipo de reactividad se observa generalmente con los metales de la primera fila, que prefieren un cambio de una unidad en el estado de oxidación, pero se ha observado tanto en metales de la segunda como de la tercera fila. [4]
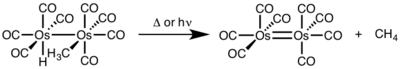
Al igual que con la adición oxidativa, son posibles varios mecanismos con la eliminación reductora. El mecanismo principal es una vía concertada , lo que significa que es un estado de transición no polar, de tres centros con retención de la estereoquímica . Además, un mecanismo S N 2 , que procede con la inversión de la estereoquímica, o un mecanismo radical , que procede con la obliteración de la estereoquímica, son otras vías posibles para la eliminación reductora. [1]
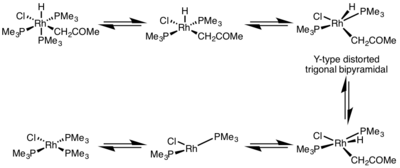
La velocidad de eliminación reductora está muy influenciada por la geometría del complejo metálico. En los complejos octaédricos , la eliminación reductora puede ser muy lenta desde el centro saturado de coordinación y, a menudo, la eliminación reductora solo se produce a través de un mecanismo disociativo , donde un ligando debe disociarse inicialmente para formar un complejo de cinco coordenadas. Este complejo adopta una estructura bipiramidal trigonal distorsionada de tipo Y , donde un ligando donador π está en la posición basal y los dos grupos que se eliminarán se acercan mucho. Después de la eliminación, se forma un complejo de tres coordenadas en forma de T, que se asociará con un ligando para formar el complejo de cuatro coordenadas plano cuadrado . [5]
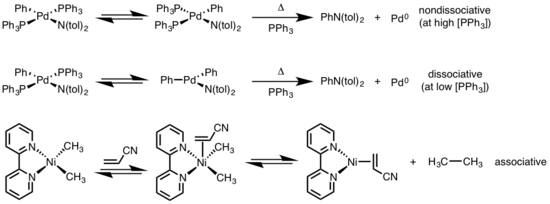
La eliminación reductiva de complejos planos cuadrados puede progresar a través de una variedad de mecanismos: disociativo , no disociativo y asociativo . De manera similar a los complejos octaédricos, un mecanismo disociativo para complejos planos cuadrados se inicia con la pérdida de un ligando, generando un intermediario de tres coordenadas que sufre una eliminación reductiva para producir un complejo metálico de una sola coordinación. Para una vía no disociativa, la eliminación reductiva ocurre a partir del sistema de cuatro coordenadas para producir un complejo de dos coordenadas. Si los ligandos eliminadores son trans entre sí, el complejo primero debe sufrir una isomerización de trans a cis antes de eliminarse. En un mecanismo asociativo, un ligando debe asociarse inicialmente con el complejo metálico de cuatro coordenadas para generar un complejo de cinco coordenadas que sufre una eliminación reductiva, sinónimo del mecanismo de disociación para complejos octaédricos. [6] [7]
La eliminación reductiva es sensible a una variedad de factores, entre ellos: 1) identidad del metal y densidad electrónica; 2) estérica; 3) ligandos participantes; 4) número de coordinación ; 5) geometría ; y 6) fotólisis /oxidación. Además, debido a que la eliminación reductiva y la adición oxidativa son reacciones inversas, cualquier estérica o electrónica que mejore la tasa de eliminación reductiva debe obstaculizar termodinámicamente la tasa de adición oxidativa. [2]
Los complejos metálicos de primera fila tienden a sufrir una eliminación reductora más rápida que los complejos metálicos de segunda fila, que tienden a ser más rápidos que los complejos metálicos de tercera fila. Esto se debe a la fuerza de enlace, siendo los enlaces metal-ligando en los complejos de primera fila más débiles que los enlaces metal-ligando en los complejos de tercera fila. Además, los centros metálicos pobres en electrones sufren una eliminación reductora más rápida que los centros metálicos ricos en electrones, ya que el metal resultante ganaría densidad electrónica tras la eliminación reductora. [8]
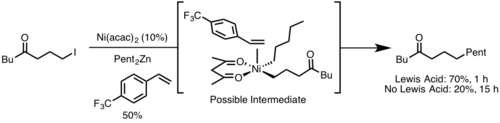
La eliminación reductiva generalmente ocurre más rápidamente a partir de un centro metálico con mayor impedimento estérico porque el estorbo estérico se alivia con la eliminación reductiva. Además, los ángulos de mordida amplios del ligando generalmente aceleran la eliminación reductiva porque los impedimentos estéricos fuerzan a los grupos eliminadores a acercarse más, lo que permite una mayor superposición orbital . [9]
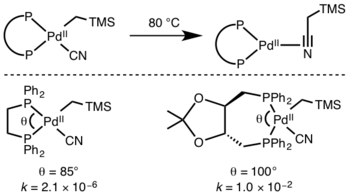
La cinética de eliminación reductiva es difícil de predecir, pero las reacciones que involucran hidruros son particularmente rápidas debido a los efectos de la superposición orbital en el estado de transición. [10]

La eliminación reductiva se produce más rápidamente en el caso de complejos con centros metálicos de tres o cinco coordenadas que en el caso de complejos con centros metálicos de cuatro o seis coordenadas. En el caso de complejos con números de coordinación pares, la eliminación reductiva conduce a un intermediario con un orbital antienlazante metal-ligando fuertemente . Cuando la eliminación reductiva se produce en complejos con números de coordinación impares, el intermediario resultante ocupa un orbital molecular no enlazante . [11]

La eliminación reductiva generalmente ocurre más rápidamente para los complejos cuyas estructuras se asemejan al producto. [2]
La eliminación reductiva se puede inducir oxidando el centro metálico a un estado de oxidación más alto mediante luz o un oxidante. [12]
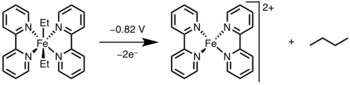
La eliminación reductora ha encontrado una amplia aplicación en el ámbito académico y en la industria, siendo las más notables la hidrogenación , [13] el proceso de ácido acético de Monsanto , [14] la hidroformilación , [15] y las reacciones de acoplamiento cruzado . [16] En muchos de estos ciclos catalíticos, la eliminación reductora es el paso de formación del producto y regenera el catalizador; sin embargo, en la reacción de Heck [17] y el proceso Wacker , [18] la eliminación reductora solo está involucrada en la regeneración del catalizador, ya que los productos en estas reacciones se forman a través de la eliminación de β-hidruro .