
La ribozima cabeza de martillo es un motivo de ARN que cataliza reacciones de escisión y ligadura reversibles en un sitio específico dentro de una molécula de ARN. Es uno de los varios ARN catalíticos ( ribozimas ) que se sabe que existen en la naturaleza. Sirve como un sistema modelo para la investigación sobre la estructura y las propiedades del ARN, y se utiliza para experimentos de escisión de ARN dirigidos, algunos con aplicaciones terapéuticas propuestas. Llamadas así por la semejanza de los primeros diagramas de estructura secundaria con un tiburón martillo , [1] las ribozimas cabeza de martillo se descubrieron originalmente en dos clases de ARN similares a virus de plantas: ARN satélite y viroides . También se conocen en algunas clases de retrotransposones , incluidas las retrozimas . [2] El motivo de la ribozima cabeza de martillo se ha informado de forma ubicua en linajes a lo largo del árbol de la vida. [3] [4]
Las reacciones de autoescisión, descritas por primera vez en 1986, [5] [6] son parte de un mecanismo de replicación de círculo rodante . La secuencia de cabeza de martillo es suficiente para la autoescisión [7] y actúa formando una estructura terciaria tridimensional conservada.
En su estado natural, un motivo de ARN cabeza de martillo es una sola hebra de ARN. Aunque la escisión se produce en ausencia de enzimas proteicas , el ARN cabeza de martillo en sí no es un catalizador en su estado natural, ya que es consumido por la reacción (es decir, realiza la autoescisión) y, por lo tanto, no puede catalizar múltiples renovaciones.
Los constructos de cabeza de martillo que actúan en trans pueden diseñarse de tal manera que consten de dos hebras de ARN que interactúan, con una hebra que compone una ribozima de cabeza de martillo que escinde la otra hebra. [8] [ cita requerida ] La hebra que se escinde puede suministrarse en exceso, y se puede demostrar que el recambio múltiple obedece a la cinética de Michaelis-Menten , [8] [ cita requerida ] típica de la cinética de enzimas proteicas . Dichos constructos se emplean típicamente para experimentos in vitro , y el término "ARN de cabeza de martillo" se ha convertido en la práctica en sinónimo del término más frecuentemente utilizado " ribozima de cabeza de martillo ".
La secuencia mínima de ribozima en forma de cabeza de martillo que actúa en trans y que es catalíticamente activa consta de tres tallos con pares de bases que flanquean un núcleo central de 15 nucleótidos conservados (en su mayoría invariantes) , como se muestra. Las bases centrales conservadas, con pocas excepciones, son esenciales para la actividad catalítica de la ribozima. Tales construcciones de ribozima en forma de cabeza de martillo exhiben in vitro una tasa de recambio ( k cat ) de aproximadamente 1 molécula/minuto y una K m del orden de 10 nanomolar.
Se podría decir que la ribozima cabeza de martillo es la ribozima mejor caracterizada. Su pequeño tamaño, su química de escisión minuciosamente investigada, su estructura cristalina conocida y su relevancia biológica hacen que la ribozima cabeza de martillo sea particularmente adecuada para investigaciones bioquímicas y biofísicas sobre la naturaleza fundamental de la catálisis del ARN.
Las ribozimas de cabeza de martillo pueden desempeñar un papel importante como agentes terapéuticos, como enzimas que adaptan secuencias de ARN definidas, como biosensores y para aplicaciones en genómica funcional y descubrimiento de genes. [9]
En 1986, se encontraron las primeras ribozimas de cabeza de martillo en patógenos vegetales de ARN como viroides y satélites virales. [5] [6] Un año después, también se informó de una ribozima de cabeza de martillo en el ADN satélite de genomas de tritón. [10] Luego se encontraron nuevos ejemplos de esta ribozima en los genomas de organismos no relacionados como esquistosomas, [11] grillos de cueva, [12] Arabidopsis thaliana [13] y algunos mamíferos como roedores y el ornitorrinco. [14] En 2010, se descubrió que la ribozima de cabeza de martillo se presenta en una amplia variedad de genomas bacterianos y eucariotas, [15] incluso en humanos. [16] Informes similares confirmaron y ampliaron estas observaciones, [17] [18] [19] revelando que la ribozima de cabeza de martillo es un ARN catalítico ubicuo en todos los reinos de la vida. [20]
La mayoría de las ribozimas eucariotas de cabeza de martillo están relacionadas con un tipo de retroelementos cortos intercalados (SINE) llamados retrozimas , que se expresan como pequeños ARN circulares. [21] Sin embargo, se puede encontrar un grupo excepcional de cabezas de martillo sorprendentemente conservadas en los genomas de todos los amniotas . [16] Estas ribozimas de cabeza de martillo (las llamadas HH9 y HH10) se encuentran en los intrones de unos pocos genes específicos y apuntan a un papel biológico preservado durante la biosíntesis de pre-ARNm. [22] En 2021, se descubrió que nuevos genomas del virus de la hepatitis D de ARN circular de diversos animales codificaban ribozimas de cabeza de martillo similares a las presentes en los viroides de plantas y los satélites virales. [23] Una búsqueda bioinformática masiva de agentes similares al deltavirus en todo el mundo ha descubierto cientos de ejemplos de genomas de ARN circulares que llevan motivos de cabeza de martillo, lo que indica que no solo esta ribozima sino también pequeños ARN circulares con ribozimas son moléculas omnipresentes en la biosfera. [24]
La ribozima cabeza de martillo lleva a cabo una reacción química muy simple que da como resultado la rotura de la cadena de sustrato del ARN, específicamente en C17, el nucleótido del sitio de escisión. Aunque la escisión del ARN a menudo se denomina hidrólisis , el mecanismo empleado de hecho no implica la adición de agua . Más bien, la reacción de escisión es simplemente una isomerización que consiste en la reorganización del enlace fosfodiéster de enlace . Es la misma reacción, químicamente, que ocurre con la degradación del ARN mediada por bases aleatorias , excepto que es altamente específica del sitio y la velocidad se acelera 10.000 veces o más.

La reacción de escisión es una reacción de isomerización de fosfodiéster que se inicia mediante la abstracción del protón 2'-hidroxilo de la ribosa del sitio de escisión del oxígeno 2', que luego se convierte en el nucleófilo atacante en una reacción "en línea" o similar a SN 2(P) , aunque no se sabe si este protón se elimina antes o durante el paso químico de la reacción de escisión de cabeza de martillo. (La reacción de escisión técnicamente no es bimolecular , pero se comporta de la misma manera que lo hace una reacción SN 2(P) genuina ; sufre una inversión de configuración posterior a la formación de un estado de transición asociativo que consiste en un oxifosfrano pentacoordinado). Los oxígenos del grupo atacante y saliente ocuparán las dos posiciones axiales en la estructura de estado de transición bipiramidal trigonal como se requiere para un mecanismo de reacción similar a SN 2.
El producto 5', como resultado de este mecanismo de reacción de escisión, posee un extremo terminal de fosfato cíclico 2',3', y el producto 3' posee un extremo terminal 5'-OH, como con la escisión alcalina no enzimática del ARN. Por lo tanto, la reacción es reversible, ya que el fosfato escindible sigue siendo un fosfodiéster y, por lo tanto, puede actuar como sustrato para la ligadura mediada por ARN cabeza de martillo sin un requisito de ATP o una fuente de energía exógena similar. [25] La reacción catalizada por ribozima cabeza de martillo, a diferencia de la escisión alcalina no enzimática formalmente idéntica del ARN, es una reacción de escisión altamente específica de secuencia con una tasa de recambio típica de aproximadamente 1 molécula de sustrato por molécula de enzima por minuto a pH 7,5 en 10 mM Mg 2+ (las llamadas "condiciones de reacción estándar" para la secuencia mínima de ARN cabeza de martillo), dependiendo de la secuencia del constructo particular de ribozima cabeza de martillo medido. Esto representa una mejora de la tasa de aproximadamente 10.000 veces con respecto a la escisión no enzimática del ARN.
Originalmente se pensaba que todas las ribozimas eran metaloenzimas . Se suponía que los iones metálicos divalentes como el Mg2 + tenían dos funciones: promover el plegamiento adecuado del ARN y formar el núcleo catalítico. [26] Dado que el ARN en sí no contenía suficiente variación en los grupos funcionales, se pensó que los iones metálicos desempeñaban un papel en el sitio activo, como se sabía sobre las proteínas. El mecanismo propuesto para el ion Mg2+ era: la desprotonación del grupo 2'-OH por un complejo Magnesium.aqua.hidroxi unido por el oxígeno pro-R en el sitio de escisión del fosfato, seguido de un ataque nucleofílico del 2'-alcaóxido resultante sobre el fosfato escindible formando un intermediario de fosfato pentacoordinado. El último paso es la salida del grupo saliente 5', produciendo un fosfato 2',3'-cíclico con una configuración invertida. [27]
Se presumió que los iones de magnesio hexahidratados , que existen en equilibrio con el hidróxido de magnesio , podrían desempeñar los papeles de ácido general y base general , de una manera análoga a los desempeñados por dos histidinas en la ARNasa A. También se ha propuesto un papel adicional para los iones metálicos divalentes en forma de estabilización electrostática del estado de transición .
En 1998 se descubrió [28] que la ribozima cabeza de martillo, así como la ribozima VS y la ribozima horquilla , no requieren la presencia de iones metálicos para la catálisis, siempre que esté presente una concentración suficientemente alta de catión monovalente para permitir que el ARN se pliegue. Este descubrimiento sugirió que el ARN en sí, en lugar de servir como un andamiaje pasivo e inerte para la unión de iones metálicos divalentes químicamente activos, está íntimamente involucrado en la química de la catálisis. Los últimos resultados estructurales, descritos a continuación, confirman de hecho que dos nucleótidos invariantes, G12 y G8, están posicionados de manera consistente con los roles como base general y ácido general en la reacción de escisión de la ribozima cabeza de martillo.
Estrictamente hablando, por lo tanto, la ribozima cabeza de martillo no puede ser una metaloenzima.
La secuencia mínima de cabeza de martillo que se requiere para la reacción de autoescisión incluye aproximadamente 13 nucleótidos "centrales" conservados o invariantes, la mayoría de los cuales no están involucrados en la formación de pares de bases Watson-Crick canónicos . La región central está flanqueada por los tallos I, II y III, que en general están hechos de pares de bases Watson-Crick canónicos pero que, por lo demás, no están restringidos con respecto a la secuencia. La tasa de recambio catalítico de las ribozimas de cabeza de martillo mínimas es de ~ 1/min (se observa comúnmente un rango de 0,1/min a 10/min, dependiendo de las secuencias no conservadas y las longitudes de los tres tallos helicoidales) en condiciones de reacción estándar de alto Mg 2+ (~10 mM), pH 7,5 y 25 °C. Gran parte del trabajo experimental realizado con ribozimas de cabeza de martillo ha utilizado una construcción mínima.
Estructuralmente, la ribozima cabeza de martillo está compuesta por tres hélices de pares de bases, separadas por enlaces cortos de secuencias conservadas. Estas hélices se denominan I, II y III. Las ribozimas cabeza de martillo se pueden clasificar en tres tipos según en qué hélice se encuentren los extremos 5' y 3'. Si los extremos 5' y 3' de la secuencia contribuyen al tallo I, entonces es una ribozima cabeza de martillo de tipo I, al tallo II es un tipo II y al tallo III, entonces es una ribozima cabeza de martillo de tipo III. De los tres tipos topológicos posibles, el tipo I se puede encontrar en los genomas de procariotas, eucariotas y patógenos de plantas de ARN, mientras que el tipo II solo se ha descrito en procariotas [18] [19] y el tipo III se encuentra principalmente en plantas, patógenos de plantas y procariotas. [20] [22]
La ribozima cabeza de martillo de longitud completa consta de elementos de secuencia adicionales en los tallos I y II que permiten la formación de contactos terciarios adicionales. Las interacciones terciarias estabilizan la conformación activa de la ribozima, lo que da como resultado tasas de escisión hasta 1000 veces mayores que las de las secuencias de cabeza de martillo mínimas correspondientes. [29] [30]
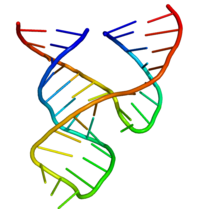
La ribozima cabeza de martillo mínima ha sido estudiada exhaustivamente por bioquímicos y enzimólogos, así como por cristalógrafos de rayos X, espectroscopistas de RMN y otros profesionales de las técnicas biofísicas. La primera información estructural tridimensional detallada para una ribozima cabeza de martillo apareció en 1994 en forma de una estructura cristalina de rayos X de una ribozima cabeza de martillo unida a un sustrato análogo de ADN, publicada en Nature por Pley, Flaherty y McKay. [31] Posteriormente, Scott, Finch y Klug publicaron una estructura de ribozima cabeza de martillo mínima completamente de ARN en Cell a principios de 1995. [32]
La ribozima cabeza de martillo mínima está compuesta por tres hélices con pares de bases, separadas por enlaces cortos de secuencia conservada como se muestra en la estructura cristalina . [32] Estas hélices se denominan I, II y III. El giro de uridina conservado une la hélice I con la hélice II y normalmente contiene la secuencia CUGA. La hélice II y III están unidas por una secuencia GAAA. La reacción de escisión se produce entre la hélice III y la I, y normalmente es una C.
La estructura de un ribozima de longitud completa muestra que existen interacciones extensas entre el bucle del tallo II y el tallo I. [33]
Se observan estructuras similares en otras ribozimas, como las ribozimas de hacha .
A pesar de las observaciones de la catálisis del ribozima cabeza de martillo en un cristal de la secuencia mínima cabeza de martillo en el que los contactos de empaquetamiento de la red cristalina confinaban necesariamente las posiciones globales de los extremos distales de los tres tallos helicoidales flanqueantes, muchos experimentos bioquímicos diseñados para investigar las interacciones de estados de transición y la química de la catálisis parecían ser irreconciliables con las estructuras cristalinas.
Por ejemplo, se observó que los residuos centrales invariantes G5, G8, G12 y C3 en la ribozima cabeza de martillo mínima eran tan frágiles que cambiar incluso un solo grupo funcional exocíclico en cualquiera de estos nucleótidos resulta en una reducción dramática o abolición de la actividad catalítica, aunque pocos de estos parecieron formar enlaces de hidrógeno que involucraran las caras Watson-Crick de estas bases de nucleótidos en cualquiera de las estructuras cabeza de martillo mínimas, aparte de una interacción G-5 en la estructura del producto.
Un ejemplo particularmente llamativo y observado recientemente fue el de G8 y G12, que se identificaron como posibles participantes en la catálisis ácido-base. Una vez que se demostró que el ARN cabeza de martillo no requiere iones metálicos divalentes para la catálisis, gradualmente se hizo evidente que el ARN en sí, en lugar de los iones metálicos divalentes unidos pasivamente, debe desempeñar un papel químico directo en cualquier química ácido-base en el sitio activo del ribozima cabeza de martillo. Sin embargo, no estaba del todo claro cómo G12 y G8 podían lograr esto, dadas las estructuras originales del ribozima cabeza de martillo mínimo.
Otras preocupaciones incluían un NOE entre U4 y U7 del ribozima cabeza de martillo escindido que también se había observado durante la caracterización por RMN , lo que sugería que estas bases de nucleótidos debían aproximarse entre sí a una distancia menor a unos 6 Å, aunque la aproximación cercana de U7 a U4 no parecía ser posible a partir de la estructura cristalina. Finalmente, como se discutió previamente, el nucleófilo atacante en las estructuras originales, el 2'-OH de C17, no estaba en una posición que permitiera un ataque en línea sobre el fosfato escindible adyacente .
Tal vez lo más preocupante fueron los experimentos que sugerían que los fosfatos A-9 y escindibles debían estar a unos 4 Å entre sí en el estado de transición, basándose en experimentos de doble sustitución de fosforotioato y de rescate de iones metálicos blandos; la distancia entre estos fosfatos en la estructura cristalina mínima de cabeza de martillo era de unos 18 Å, sin un mecanismo claro para la aproximación si las hélices de forma A de tallo II y tallo I se trataban como cuerpos rígidos. En conjunto, estos resultados parecían sugerir que debe haberse producido un cambio conformacional a bastante gran escala para alcanzar el estado de transición dentro de la estructura mínima de la ribozima de cabeza de martillo.
Por estas razones, los dos conjuntos de experimentos (bioquímicos y cristalográficos) no sólo parecían estar en desacuerdo, sino que eran completamente irreconciliables, lo que generó una cantidad sustancial de discordia en el campo. Nunca se logró demostrar con éxito que se descartaran ninguno de los dos conjuntos de resultados experimentales, aunque se hicieron muchas afirmaciones en contra a favor de cada uno de ellos.

En 2006 se obtuvo una estructura cristalina de la ribozima cabeza de martillo de longitud completa con una resolución de 2,2 Å. Esta nueva estructura (que se muestra a la derecha) parece resolver la más preocupante de las discrepancias anteriores. En particular, C17 ahora está posicionado para el ataque en línea, y los residuos invariantes C3, G5, G8 y G12 parecen estar involucrados en interacciones vitales relevantes para la catálisis. Además, se observa que los fosfatos A9 y escindibles están separados por 4,3 Å, lo que es coherente con la idea de que, cuando se modifican, estos fosfatos podrían unirse a un solo ion metálico tiófilo. La estructura también revela cómo dos residuos invariantes, G-12 y G-8, están posicionados dentro del sitio activo, de acuerdo con su papel previamente propuesto en la catálisis ácido/base. G12 se encuentra a una distancia de enlace de hidrógeno del 2'–O de C17, el nucleófilo en la reacción de escisión, y la ribosa de G8 se enlaza con el grupo saliente 5'-O (ver abajo), mientras que la base nucleotídica de G8 forma un par Watson-Crick con el C3 invariante. Esta disposición permite sugerir que G12 es la base general en la reacción de escisión, y que G8 puede funcionar como el ácido general, en consonancia con observaciones bioquímicas previas. G5 se enlaza con el oxígeno furanosa de C17, lo que ayuda a posicionarlo para el ataque en línea. U4 y U7, como consecuencia de la formación de pares de bases entre G8 y C3, ahora están posicionados de tal manera que una NOE entre sus bases se explica fácilmente.
De este modo, la estructura cristalina del ribozima cabeza de martillo de longitud completa aborda claramente todas las preocupaciones principales que parecían irreconciliables con las estructuras cristalinas anteriores del ribozima cabeza de martillo mínimo.

Las interacciones terciarias en la ribosa cabeza de martillo de longitud completa estabilizan lo que parece ser la conformación activa. El nucleófilo, el oxígeno 2' del nucleótido del sitio de escisión, C17, está alineado casi perfectamente para un ataque en línea (la reacción S N 2(P)). G12 está ubicado dentro de la distancia de enlace de hidrógeno de este nucleófilo y, por lo tanto, podría abstraer un protón del oxígeno 2' si el propio G12 se desprotona. El 2'-OH de G8 forma un enlace de hidrógeno con el oxígeno del grupo saliente 5' y, por lo tanto, potencialmente puede suministrar un protón a medida que se acumula carga negativa en el oxígeno 5' de la ribosa de A1.1.
La explicación más probable es que G12, en la forma desprotonada, sea la base general, y la ribosa de G8 sea el ácido general. El pKa cinético aparente [ aclaración necesaria ] de la ribozima cabeza de martillo es 8,5, mientras que el pKa de la guanosina es de aproximadamente 9,5. Es posible que el pKa de G12 se altere de 9,5 a 8,5 en el núcleo catalítico de la cabeza de martillo; esta hipótesis es actualmente objeto de intensa investigación.

Si el invariante G8 se cambia por C8, se elimina la catálisis de cabeza de martillo. Sin embargo, un doble mutante G8C + C3G que mantiene el par de bases G8-C3 que se encuentra en la cabeza de martillo de longitud completa restaura la mayor parte de la actividad catalítica. También se ha observado que el 2'-OH de G8 es esencial para la catálisis; el reemplazo de G8 por desoxiG8 reduce en gran medida la tasa de catálisis, lo que sugiere que el 2'-OH es de hecho crucial para el mecanismo catalítico.
La proximidad de los fosfatos A9 y escindibles requiere la presencia de una alta concentración de carga positiva. Esta es probablemente la fuente de la observación de que se requieren iones metálicos divalentes con baja fuerza iónica, pero se puede prescindir de ellos con concentraciones más altas de cationes monovalentes.
Por lo tanto, es probable que la reacción implique la abstracción del protón 2' de C17, seguida de un ataque nucleofílico al fosfato adyacente. A medida que el enlace entre el fósforo escindible y el grupo saliente 5'-O comienza a romperse, se aporta un protón de la ribosa de G8, que luego probablemente se reprotona a expensas de una molécula de agua que se observa que forma un enlace de hidrógeno con ella en la estructura cristalina.
Se están probando ribozimas de cabeza de martillo modificadas como agentes terapéuticos. [34] Se están estudiando ARN sintéticos que contienen secuencias complementarias al ARNm de SOD1 mutante y secuencias necesarias para formar la estructura catalítica de cabeza de martillo como una posible terapia para la esclerosis lateral amiotrófica . También se está trabajando para averiguar si podrían usarse para diseñar líneas de células T resistentes al VIH . Se ha demostrado que los adenovirus con ribozimas de cabeza de martillo modificadas son potentes en el tratamiento del cáncer tanto in vitro como in vivo. [35]
El uso terapéutico de las ribozimas cabeza de martillo que escinden trans se ha visto gravemente obstaculizado por su baja actividad in vivo . El verdadero potencial catalítico de las ribozimas cabeza de martillo que escinden trans puede recuperarse in vivo y es probable que los derivados terapéuticos complementen otras estrategias terapéuticas de hibridación de ácidos nucleicos. Ya existen ribozimas cabeza de martillo que están cerca de su aplicación clínica. [9]