Una reacción de Norrish , llamada así en honor a Ronald George Wreyford Norrish , es una reacción fotoquímica que tiene lugar con cetonas y aldehídos . Dichas reacciones se subdividen en reacciones de Norrish tipo I y reacciones de Norrish tipo II . [1] Si bien tienen una utilidad sintética limitada, estas reacciones son importantes en la fotooxidación de polímeros como poliolefinas , [2] poliésteres , ciertos policarbonatos y policetonas .
La reacción de tipo I de Norrish es la escisión fotoquímica u homólisis de aldehídos y cetonas en dos intermediarios de radicales libres (α-escisión). El grupo carbonilo acepta un fotón y se excita a un estado fotoquímico singlete . A través del cruce entre sistemas se puede obtener el estado triplete . Al escindir el enlace α-carbono de cualquiera de los estados, se obtienen dos fragmentos radicales. [3] El tamaño y la naturaleza de estos fragmentos dependen de la estabilidad de los radicales generados; por ejemplo, la escisión de 2-butanona produce en gran medida radicales etilo en favor de radicales metilo menos estables. [4]
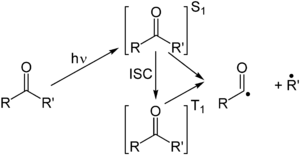
Dependiendo de la estructura molecular exacta, estos fragmentos pueden tener varios modos de reacción secundarios.

La utilidad sintética de este tipo de reacción es limitada, por ejemplo, a menudo es una reacción secundaria en la reacción de Paternò-Büchi . Una síntesis orgánica basada en esta reacción es la del biciclohexilideno. [7] La reacción de Norrish Tipo I desempeña un papel crucial en el campo de la fotopolimerización, particularmente en el desarrollo de fotoiniciadores utilizados para la polimerización de dos fotones (2PP). La reacción de Norrish Tipo I es particularmente significativa aquí porque implica la escisión de un enlace carbono-carbono en una molécula de fotoiniciador tras la excitación por luz UV o visible, lo que conduce a la formación de dos especies radicales. Estos radicales son altamente reactivos y pueden iniciar eficazmente la polimerización de monómeros en una región localizada, lo que permite la estructuración 3D precisa requerida en los procesos de polimerización de dos fotones. Esto hace que la reacción de Norrish Tipo I sea un mecanismo fundamental para diseñar fotoiniciadores que sean capaces de impulsar la fabricación aditiva de alta resolución a microescala. [8]
Una reacción tipo II de Norrish es la abstracción intramolecular fotoquímica de un γ-hidrógeno (un átomo de hidrógeno a tres posiciones de carbono del grupo carbonilo) por el compuesto carbonílico excitado para producir un birradical 1,4 como fotoproducto primario. [9] Norrish informó por primera vez sobre la reacción en 1937. [10]

Las reacciones secundarias que ocurren son la fragmentación (β-escisión) para formar un alqueno y un enol (que se tautomerizará rápidamente a un carbonilo), o la recombinación intramolecular de los dos radicales a un ciclobutano sustituido (la reacción de Norrish-Yang ). [11]
La reacción de Norrish se ha estudiado en relación con la química ambiental con respecto a la fotólisis del aldehído heptanal , un compuesto prominente en la atmósfera de la Tierra. [12] La fotólisis del heptanal en condiciones similares a las atmosféricas da como resultado la formación de 1-penteno y acetaldehído con un rendimiento químico del 62% junto con alcoholes cíclicos ( ciclobutanoles y ciclopentanoles ) ambos a partir de un canal tipo II de Norrish y alrededor del 10% de rendimiento de hexanal a partir de un canal tipo I de Norrish (el radical n-hexilo formado inicialmente atacado por el oxígeno).
En un estudio [13], la fotólisis de un derivado de aciloína en agua en presencia de tetracloroaurato de hidrógeno (HAuCl 4 ) generó nanopartículas de oro con un diámetro de 10 nanómetros . La especie que se cree que es responsable de reducir Au 3+ a Au 0 [14] es el radical cetilo generado por Norrish .

La síntesis de dodecaedro de Leo Paquette en 1982 implica tres reacciones separadas de tipo Norrish en su secuencia de aproximadamente 29 pasos.
Un ejemplo de una reacción de Norrish tipo II sintéticamente útil se puede encontrar al principio de la síntesis total de la ouabagenina cardenolida biológicamente activa por Phil Baran y colaboradores. [15] Las condiciones optimizadas minimizan las reacciones secundarias, como la vía competitiva de Norrish tipo I, y proporcionan el intermedio deseado con un buen rendimiento en una escala de varios gramos.

{{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda )