
En química , un puente salino es una combinación de dos interacciones no covalentes : enlace de hidrógeno y enlace iónico (Figura 1). El emparejamiento iónico es una de las fuerzas no covalentes más importantes en química, en sistemas biológicos, en diferentes materiales y en muchas aplicaciones como la cromatografía de pares iónicos . Es una contribución observada más comúnmente a la estabilidad de la conformación plegada entrópicamente desfavorable de las proteínas. Aunque se sabe que las interacciones no covalentes son interacciones relativamente débiles, pequeñas interacciones estabilizadoras pueden sumar una contribución importante a la estabilidad general de un confórmero. [1] Los puentes salinos no solo se encuentran en las proteínas, sino que también se pueden encontrar en la química supramolecular . La termodinámica de cada uno se explora a través de procedimientos experimentales para acceder a la contribución de energía libre del puente salino a la energía libre general del estado.
En el agua, la formación de puentes salinos o pares iónicos está impulsada principalmente por la entropía, generalmente acompañada de contribuciones desfavorables de ΔH debido a la desolvatación de los iones que interactúan tras la asociación. [2] Los enlaces de hidrógeno contribuyen a la estabilidad de los pares iónicos con, por ejemplo, iones de amonio protonados , y con aniones se forman por desprotonación como en el caso del carboxilato , fosfato , etc.; entonces las constantes de asociación dependen del pH. Las fuerzas impulsoras entrópicas para el apareamiento iónico (en ausencia de contribuciones significativas de enlaces H) también se encuentran en el metanol como disolvente. En el contacto con disolventes no polares se forman pares iónicos con constantes de asociación muy altas; [3] [4] en la fase gaseosa, las energías de asociación de, por ejemplo, haluros alcalinos alcanzan hasta 200 kJ/mol. [5] La ecuación de Bjerrum o de Fuoss describe la asociación de pares iónicos en función de las cargas iónicas zA y zB y la constante dieléctrica ε del medio; un gráfico correspondiente de la estabilidad ΔG frente a zAzB muestra para más de 200 pares de iones la correlación lineal esperada para una gran variedad de iones. [6] Los iones inorgánicos y orgánicos muestran una fuerza iónica moderada y una asociación de puente salino similar. Valores de ΔG de alrededor de 5 a 6 kJ/mol para una combinación 1:1 de anión y catión, casi independiente de la naturaleza (tamaño, polarizabilidad, etc.) de los iones. [7] [8] Los valores de ΔG son aditivos y aproximadamente una función lineal de las cargas; la interacción de, por ejemplo, un anión fosfato doblemente cargado con un catión amonio con carga única representa aproximadamente 2x5 = 10 kJ/mol. Los valores de ΔG dependen de la fuerza iónica I de la solución, como se describe en la ecuación de Debye-Hückel , con fuerza iónica cero se observa ΔG = 8 kJ/mol. Las estabilidades de los pares de iones álcali en función de la carga del anión zby se pueden describir mediante una ecuación más detallada. [9]
El puente salino surge con mayor frecuencia del carboxilato aniónico (RCOO − ) del ácido aspártico o del ácido glutámico y del amonio catiónico (RNH 3 + ) de la lisina o del guanidinio (RNHC(NH 2 ) 2 + ) de la arginina (Figura 2). . [1] Aunque estos son los más comunes, también pueden participar otros residuos con cadenas laterales ionizables como histidina , tirosina y serina , dependiendo de factores externos que perturben sus p K a . También se cita como importante la distancia entre los residuos que participan en el puente salino. La distancia NO requerida es inferior a 4 Å (400 pm). Los aminoácidos que están separados por más de esta distancia no califican como formadores de un puente salino. [11] Debido a las numerosas cadenas laterales ionizables de aminoácidos que se encuentran en toda una proteína, el pH al que se coloca una proteína es crucial para su estabilidad.
También se pueden formar puentes salinos entre una proteína y ligandos de moléculas pequeñas. Se descubrió que más de 1100 complejos proteína-ligando únicos del Protein Databank forman puentes salinos con sus objetivos proteicos, lo que indica que los puentes salinos son frecuentes en la interacción fármaco-proteína. [12] Estos contienen estructuras de diferentes clases de enzimas, incluidas hidrolasas, transferasas, quinasas, reductasa, oxidorreductasa, liasas y receptores acoplados a proteína G (GPCR). Estudios recientes han demostrado que los puentes salinos desempeñan un papel importante en la estabilización de los complejos proteína-ligando al actuar como clips moleculares que estabilizan la conformación de la proteína y pueden aumentar la actividad inhibidora en cientos de veces. [13] Por lo tanto, la incorporación de puentes salinos entre los ligandos y sus objetivos proteicos podría ser una herramienta valiosa en el diseño racional de fármacos.

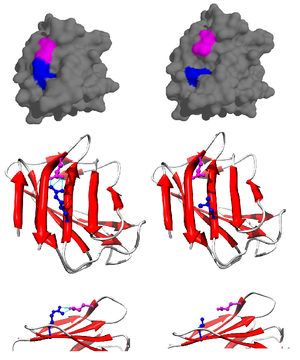
La contribución de un puente salino a la estabilidad general del estado plegado de una proteína se puede evaluar mediante datos termodinámicos recopilados de estudios de mutagénesis y técnicas de resonancia magnética nuclear. [14] Usando una proteína mutada de tipo pseudo-salvaje específicamente mutada para prevenir la precipitación a pH alto, la contribución del puente salino a la energía libre general del estado de la proteína plegada se puede determinar realizando una mutación puntual, alterando y, en consecuencia, rompiendo el puente de sal. Por ejemplo, se identificó la existencia de un puente salino en la lisozima T4 entre el ácido aspártico (Asp) en el residuo 70 y una histidina (His) en el residuo 31 (Figura 3). Se realizó mutagénesis dirigida con asparagina (Asn) (Figura 4) obteniendo tres nuevos mutantes: Asp70Asn His31 (Mutante 1), Asp70 His31Asn (Mutante 2) y Asp70Asn His31Asn (Doble Mutante).

Una vez establecidos los mutantes, se pueden emplear dos métodos para calcular la energía libre asociada con un puente salino. Un método implica la observación de la temperatura de fusión de la proteína de tipo salvaje frente a la de los tres mutantes. La desnaturalización se puede controlar mediante un cambio en el dicroísmo circular . Una reducción en la temperatura de fusión indica una reducción en la estabilidad. Esto se cuantifica mediante un método descrito por Becktel y Schellman donde la diferencia de energía libre entre ambos se calcula mediante Δ T Δ S . [15] Hay algunos problemas con este cálculo y solo se puede utilizar con datos muy precisos. [ cita necesaria ] En el ejemplo de lisozima T4, Δ S del tipo pseudo-salvaje se había informado previamente a pH 5,5, por lo que la diferencia de temperatura del punto medio de 11 °C a este pH se multiplicó por el Δ S informado de 360 cal/(mol ·K) (1,5 kJ/(mol·K)) produce un cambio de energía libre de aproximadamente −4 kcal/mol (−17 kJ/mol). Este valor corresponde a la cantidad de energía libre aportada a la estabilidad de la proteína por el puente salino.

El segundo método utiliza espectroscopia de resonancia magnética nuclear para calcular la energía libre del puente salino. Se realiza una titulación, mientras se registra el desplazamiento químico correspondiente a los protones del carbono adyacente al grupo carboxilato o amonio. El punto medio de la curva de titulación corresponde al p K a , o el pH donde la proporción de moléculas protonadas: desprotonadas es 1:1. Siguiendo con el ejemplo de la lisozima T4, se obtiene una curva de titulación mediante la observación de un cambio en el protón C2 de la histidina 31 (Figura 5). La Figura 5 muestra el cambio en la curva de titulación entre el tipo salvaje y el mutante en el que Asp70 es Asn. El puente salino formado se encuentra entre el Asp70 desprotonado y el His31 protonado. Esta interacción provoca el cambio observado en p K a de His31 . En la proteína de tipo salvaje desplegada, donde el puente salino está ausente, se informa que His31 tiene una pKa de 6,8 en tampones de H2O de fuerza iónica moderada. La Figura 5 muestra ap K a del tipo salvaje de 9,05. Esta diferencia en p K a está respaldada por la interacción de His31 con Asp70. Para mantener el puente salino, His31 intentará conservar su protón el mayor tiempo posible. Cuando se rompe el puente salino, como en el mutante D70N, el p K a vuelve a un valor de 6,9, mucho más cercano al de His31 en el estado desplegado.
La diferencia en p K a se puede cuantificar para reflejar la contribución del puente salino a la energía libre. Usando energía libre de Gibbs : Δ G = − RT ln( K eq ), donde R es la constante universal de los gases, T es la temperatura en kelvins y K eq es la constante de equilibrio de una reacción en equilibrio. La desprotonación de His31 es una reacción de equilibrio ácido con una Keq especial conocida como constante de disociación ácida , K a : His31-H + ⇌ His31 + H + . Entonces, p K a se relaciona con K a de la siguiente manera: p K a = −log( K a ). El cálculo de la diferencia de energía libre del mutante y del tipo salvaje ahora se puede realizar utilizando la ecuación de energía libre, la definición de p K a , los valores observados de p K a y la relación entre logaritmos naturales y logaritmos. En el ejemplo de la lisozima T4, este enfoque produjo una contribución calculada de aproximadamente 3 kcal/mol a la energía libre total. [14] Se puede adoptar un enfoque similar con el otro participante en el puente salino, como Asp70 en el ejemplo de la lisozima T4, monitoreando su cambio en p K a después de la mutación de His31.
Una palabra de precaución al elegir el experimento apropiado implica la ubicación del puente salino dentro de la proteína. El entorno juega un papel importante en la interacción. [16] A altas fuerzas iónicas, el puente salino puede quedar completamente enmascarado ya que se trata de una interacción electrostática. El puente salino His31-Asp70 en la lisozima T4 estaba enterrado dentro de la proteína. La entropía juega un papel más importante en los puentes salinos superficiales donde los residuos que normalmente tienen la capacidad de moverse están restringidos por su interacción electrostática y enlaces de hidrógeno. Se ha demostrado que esto disminuye la entropía lo suficiente como para casi borrar la contribución de la interacción. [17] Los puentes salinos superficiales se pueden estudiar de manera similar a los puentes salinos enterrados, empleando ciclos dobles mutantes y valoraciones de RMN. [18] Aunque existen casos en los que los puentes de sal enterrados contribuyen a la estabilidad, como cualquier otra cosa, existen excepciones y los puentes de sal enterrados pueden mostrar un efecto desestabilizador. [11] Además, los puentes salinos superficiales, bajo ciertas condiciones, pueden mostrar un efecto estabilizador. [16] [18] El efecto estabilizador o desestabilizador debe evaluarse caso por caso y pocas declaraciones generales pueden hacerse.

La química supramolecular es un campo que se ocupa de las interacciones no covalentes entre macromoléculas. Los químicos de este campo han utilizado los puentes salinos de formas diversas y creativas, incluida la detección de aniones, la síntesis de cápsulas moleculares y polímeros de doble hélice.
Las principales contribuciones de la química supramolecular se han dedicado al reconocimiento y detección de aniones. [19] [20] [21] [22] [23] [24] El apareamiento iónico es la fuerza impulsora más importante para la complejación de aniones, pero se ha logrado selectividad, por ejemplo, dentro de la serie de haluros, principalmente mediante contribuciones de enlaces de hidrógeno.
Las cápsulas moleculares son estructuras químicas diseñadas para capturar y retener una molécula huésped (ver encapsulación molecular ). Szumna y sus compañeros desarrollaron una nueva cápsula molecular con un interior quiral . [25] Esta cápsula está hecha de dos mitades, como un huevo de Pascua de plástico (Figura 6). Las interacciones del puente salino entre las dos mitades hacen que se autoensamblen en solución (Figura 7). Son estables incluso cuando se calientan a 60 °C.
Yashima y sus compañeros han utilizado puentes salinos para construir varios polímeros que adoptan una conformación de doble hélice muy parecida al ADN . [26] En un ejemplo, incorporaron platino para crear un metalopolímero de doble hélice. [27] A partir de su monómero y bifenilo de platino (II) (Figura 8), su metalopolímero se autoensambla a través de una serie de reacciones de intercambio de ligandos . Las dos mitades del monómero están ancladas entre sí a través del puente salino entre el carboxilato desprotonado y los nitrógenos protonados.
