El antimonio es un elemento químico ; su símbolo es Sb (del latín stibium ) y su número atómico es 51. Es un metal o metaloide gris brillante que se encuentra en la naturaleza principalmente como el mineral de sulfuro estibina (Sb 2 S 3 ). Los compuestos de antimonio se conocen desde la antigüedad y se pulverizaban para su uso como medicina y cosméticos, a menudo conocidos por el nombre árabe kohl . [8] La primera descripción conocida de este metaloide en Occidente fue escrita en 1540 por Vannoccio Biringuccio .
China es el mayor productor de antimonio y sus compuestos, y la mayor parte de la producción proviene de la mina Xikuangshan en Hunan. Los métodos industriales para refinar el antimonio a partir de la estibina son la tostación seguida de la reducción con carbón o la reducción directa de la estibina con hierro.
Las aplicaciones más comunes del antimonio metálico son en aleaciones con plomo y estaño , que tienen propiedades mejoradas para soldaduras , balas y cojinetes lisos . Mejora la rigidez de las placas de aleación de plomo en baterías de plomo-ácido . El trióxido de antimonio es un aditivo destacado para retardantes de llama que contienen halógenos . El antimonio se utiliza como dopante en dispositivos semiconductores .


El antimonio es un elemento del grupo 15 de la tabla periódica , uno de los llamados pnicógenos , y tiene una electronegatividad de 2,05. De acuerdo con las tendencias periódicas, es más electronegativo que el estaño o el bismuto , y menos electronegativo que el telurio o el arsénico . El antimonio es estable en el aire a temperatura ambiente pero, si se calienta, reacciona con el oxígeno para producir trióxido de antimonio , Sb 2 O 3 . [9]
El antimonio es un metaloide gris plateado y brillante con una dureza de 3 en la escala de Mohs , que es demasiado blanda para marcar objetos duros. En 1931 se acuñaron monedas de antimonio en Guizhou (China ); su durabilidad era escasa y pronto se interrumpió su acuñación debido a su blandura y toxicidad. [10] El antimonio es resistente al ataque de los ácidos.
El único alótropo estable del antimonio en condiciones estándar [11] es metálico, quebradizo , blanco plateado y brillante. Cristaliza en una celda trigonal , isomorfa con el bismuto y el alótropo gris del arsénico , y se forma cuando el antimonio fundido se enfría lentamente. El antimonio negro amorfo se forma al enfriarse rápidamente el vapor de antimonio y solo es estable como una película delgada (espesor en nanómetros); las muestras más gruesas se transforman espontáneamente en la forma metálica. [12] Se oxida en el aire y puede encenderse espontáneamente. A 100 °C, se transforma gradualmente en la forma estable. El supuesto alótropo amarillo del antimonio, generado solo por oxidación de estibina (SbH 3 ) a −90 °C, también es impuro y no es un alótropo verdadero; [13] [14] por encima de esta temperatura y con luz ambiental, se transforma en el alótropo negro más estable. [15] [16] [17] Una rara forma explosiva de antimonio se puede formar a partir de la electrólisis del tricloruro de antimonio , pero siempre contiene cloro apreciable y no es realmente un alótropo de antimonio. [13] Cuando se raya con un instrumento afilado, se produce una reacción exotérmica y se desprenden humos blancos como formas metálicas de antimonio; cuando se frota con un mortero, se produce una fuerte detonación.
El antimonio elemental adopta una estructura en capas ( grupo espacial R 3 m n.º 166) cuyas capas consisten en anillos fusionados, ondulados y de seis miembros. Los vecinos más cercanos y los siguientes más cercanos forman un complejo octaédrico irregular, con los tres átomos de cada capa doble ligeramente más cerca que los tres átomos de la siguiente. Este empaquetamiento relativamente cercano conduce a una alta densidad de 6,697 g/cm 3 , pero la unión débil entre las capas conduce a la baja dureza y fragilidad del antimonio. [9]
El antimonio tiene dos isótopos estables : 121 Sb con una abundancia natural de 57,36% y 123 Sb con una abundancia natural de 42,64%. También tiene 35 radioisótopos, de los cuales el de mayor duración es 125 Sb con una vida media de 2,75 años. Además, se han caracterizado 29 estados metaestables . El más estable de ellos es 120m1 Sb con una vida media de 5,76 días. Los isótopos que son más ligeros que el estable 123 Sb tienden a decaer por decaimiento β + , y los que son más pesados tienden a decaer por decaimiento β- , con algunas excepciones. [18] El antimonio es el elemento más ligero que tiene un isótopo con una rama de decaimiento alfa, excluyendo 8Be y otros nucleidos ligeros con emisión alfa beta-retardada. [18]

La abundancia de antimonio en la corteza terrestre se estima en 0,2 partes por millón , [19] comparable al talio con 0,5 ppm y la plata con 0,07 ppm. Es el 63.º elemento más abundante en la corteza. Aunque este elemento no es abundante, se encuentra en más de 100 especies minerales. [20] El antimonio a veces se encuentra de forma nativa (por ejemplo, en Antimony Peak ), pero con mayor frecuencia se encuentra en el sulfuro de estibina (Sb 2 S 3 ), que es el mineral de mena predominante. [19]
Los compuestos de antimonio suelen clasificarse según su estado de oxidación: Sb(III) y Sb(V). El estado de oxidación +5 es el más común. [21]
El trióxido de antimonio se forma cuando el antimonio se quema en el aire. [22] En la fase gaseosa, la molécula del compuesto es Sb
4Oh
6, pero se polimeriza al condensarse. [9] Pentóxido de antimonio ( Sb
4Oh
10) se puede formar únicamente por oxidación con ácido nítrico concentrado . [23] El antimonio también forma un óxido de valencia mixta, el tetróxido de antimonio ( Sb
2Oh
4), que contiene tanto Sb(III) como Sb(V). [23] A diferencia de los óxidos de fósforo y arsénico , estos óxidos son anfóteros , no forman oxoácidos bien definidos y reaccionan con ácidos para formar sales de antimonio.
Ácido antimonoso Sb(OH)
3Se desconoce, pero la base conjugada antimonita de sodio ( [Na
3SbO
3]
4) se forma al fusionar óxido de sodio y Sb
4Oh
6. [24] También se conocen antimonitos de metales de transición. [25] : 122 El ácido antimónico existe solo como hidrato HSb(OH)
6, formando sales como el anión antimoniato Sb(OH)−
6Cuando se deshidrata una solución que contiene este anión, el precipitado contiene óxidos mixtos. [25] : 143
El mineral de antimonio más importante es la estibina ( Sb
2S
3). Otros minerales de sulfuro incluyen pirargirita ( Ag
3SbS
3), zinkenita , jamesonita y boulangerita . [26] El pentasulfuro de antimonio no es estequiométrico , lo que presenta antimonio en el estado de oxidación +3 y enlaces S–S. [27] Se conocen varios tioantimonuros, como [Sb
6S
10]2−
y [Sb
8S
13]2−
. [28]
El antimonio forma dos series de haluros : SbX
3y SbX
5Los trihaluros SbF3, SbCl
3, SbBr
3, y SbI3son todos compuestos moleculares que tienen geometría molecular piramidal trigonal .
El trifluoruro SbF3se prepara mediante la reacción de Sb
2Oh
3con HF : [29]
Es ácido de Lewis y acepta fácilmente iones fluoruro para formar los aniones complejos SbF−
4y SbF2−
5. SbF fundido
3es un conductor eléctrico débil . El tricloruro SbCl
3se prepara disolviendo Sb
2S
3en ácido clorhídrico : [30]
Los sulfuros de arsénico no son fácilmente atacados por el ácido clorhídrico, por lo que este método ofrece una ruta hacia el Sb libre de As.

Los pentahaluros SbF5y SbCl
5tienen geometría molecular bipiramidal trigonal en la fase gaseosa, pero en la fase líquida, SbF5es polimérico , mientras que SbCl
5es monomérico. [31] SbF5Es un potente ácido de Lewis utilizado para fabricar el superácido ácido fluoroantimónico ("H 2 SbF 7 ").
Los oxihaluros son más comunes para el antimonio que para el arsénico y el fósforo. El trióxido de antimonio se disuelve en ácido concentrado para formar compuestos de oxoantimonio como SbOCl y (SbO)
2ENTONCES
4. [32]
Los compuestos de esta clase generalmente se describen como derivados de Sb 3− . El antimonio forma antimonuros con metales, como el antimonuro de indio (InSb) y el antimonuro de plata ( Ag
3[33] Los antimonuros de metales alcalinos y de cinc, como Na 3 Sb y Zn 3 Sb 2 , son más reactivos. El tratamiento de estos antimonuros con ácido produce el gas altamente inestable estibina , SbH
3: [34]
La estibina también se puede producir mediante el tratamiento de Sb3+
sales con reactivos hidruros como el borohidruro de sodio . La estibina se descompone espontáneamente a temperatura ambiente. Debido a que la estibina tiene un calor de formación positivo , es termodinámicamente inestable y, por lo tanto, el antimonio no reacciona directamente con el hidrógeno . [35]
Los compuestos de organoantimonio se preparan típicamente mediante alquilación de haluros de antimonio con reactivos de Grignard . [36] Se conoce una gran variedad de compuestos con centros Sb(III) y Sb(V), incluidos derivados cloroorgánicos mixtos, aniones y cationes. Algunos ejemplos incluyen trifenilestibina (Sb(C 6 H 5 ) 3 ) y pentafenilantimonio (Sb(C 6 H 5 ) 5 ). [37]

El sulfuro de antimonio (III) , Sb 2 S 3 , fue reconocido en el Egipto predinástico como un cosmético para los ojos ( kohl ) ya alrededor del año 3100 a. C. , cuando se inventó la paleta cosmética . [38]
En Telloh , Caldea (parte del actual Iraq ), se encontró un artefacto que se dice que es parte de un jarrón hecho de antimonio que data de alrededor del año 3000 a. C. , y en Egipto se encontró un objeto de cobre bañado en antimonio que data de entre el 2500 a. C. y el 2200 a. C. [15] Austen, en una conferencia de Herbert Gladstone en 1892, comentó que "hoy en día sólo conocemos el antimonio como un metal muy frágil y cristalino, que difícilmente podría transformarse en un jarrón útil, y por lo tanto este notable 'hallazgo' (el artefacto mencionado anteriormente) debe representar el arte perdido de hacer maleable el antimonio". [39]
El arqueólogo británico Roger Moorey no estaba convencido de que el artefacto fuera en realidad un jarrón, y mencionó que Selimkhanov, después de su análisis del objeto Tello (publicado en 1975), "intentó relacionar el metal con el antimonio natural de Transcaucasia" (es decir, metal nativo) y que "los objetos de antimonio de Transcaucasia son todos pequeños adornos personales". [39] Esto debilita la evidencia de un arte perdido "de hacer maleable el antimonio". [39]
El erudito romano Plinio el Viejo describió varias formas de preparar sulfuro de antimonio con fines médicos en su tratado Historia natural , alrededor del año 77 d. C. [40] Plinio el Viejo también hizo una distinción entre las formas "masculinas" y "femeninas" del antimonio; la forma masculina es probablemente el sulfuro, mientras que se ha sospechado que la forma femenina, que es superior, más pesada y menos friable, es antimonio metálico nativo. [41]
El naturalista griego Pedanius Dioscórides mencionó que el sulfuro de antimonio podía tostarse calentándolo con una corriente de aire. Se cree que esto producía antimonio metálico. [40]

El antimonio se describía con frecuencia en manuscritos alquímicos, incluida la Summa Perfectionis de Pseudo-Geber , escrita alrededor del siglo XIV. [42] Una descripción de un procedimiento para aislar el antimonio se da más tarde en el libro de 1540 De la pirotechnia de Vannoccio Biringuccio , [43] anterior al libro más famoso de 1556 de Agricola , De re metallica . En este contexto, a menudo se le ha atribuido incorrectamente a Agricola el descubrimiento del antimonio metálico. El libro Currus Triumphalis Antimonii (El carro triunfal del antimonio), que describe la preparación del antimonio metálico, se publicó en Alemania en 1604. Se pretendía que lo hubiera escrito un monje benedictino , que escribía bajo el nombre de Basilius Valentinus en el siglo XV; si fuera auténtico, lo que no es, sería anterior a Biringuccio. [b] [16] [46]
El antimonio metálico era conocido por el químico alemán Andreas Libavius en 1615, quien lo obtuvo añadiendo hierro a una mezcla fundida de sulfuro de antimonio, sal y tartrato de potasio . Este procedimiento producía antimonio con una superficie cristalina o estrellada. [40]
Con la llegada de desafíos a la teoría del flogisto , se reconoció que el antimonio es un elemento que forma sulfuros, óxidos y otros compuestos, al igual que otros metales. [40]
El primer descubrimiento de antimonio puro de origen natural en la corteza terrestre fue descrito por el científico sueco e ingeniero del distrito minero local Anton von Swab en 1783; la muestra tipo se recolectó de la mina de plata de Sala en el distrito minero de Bergslagen de Sala , Västmanland , Suecia. [47] [48]
La forma latina medieval, de la que las lenguas modernas y el griego bizantino tardío toman sus nombres para el antimonio, es antimonium . [49] El origen de esta palabra es incierto, y todas las sugerencias plantean alguna dificultad, ya sea de forma o de interpretación. La etimología popular , del ἀντίμοναχός anti-monachos o del francés antimoine , significaría "asesino de monjes", lo que se explica por el hecho de que muchos de los primeros alquimistas eran monjes y algunos compuestos de antimonio eran venenosos. [50]
Otra etimología popular es la palabra griega hipotética ἀντίμόνος antimonos , "contra la soledad", explicada como "no encontrado como metal", o "no encontrado sin alear". [15] Sin embargo, el griego antiguo expresaría de forma más natural el negativo puro como α- ("no"). [51] Edmund Oscar von Lippmann conjeturó una palabra griega hipotética ανθήμόνιον anthemonion , que significaría "florete", y cita varios ejemplos de palabras griegas relacionadas (pero no esa) que describen la eflorescencia química o biológica . [52]
Los primeros usos del antimonio incluyen las traducciones, en 1050-1100, por Constantino el Africano de tratados médicos árabes. [52] Varias autoridades creen que el antimonio es una corrupción de escribas de alguna forma árabe; Meyerhof lo deriva de ithmid ; [53] otras posibilidades incluyen athimar , el nombre árabe del metaloide, y un hipotético as-stimmi , derivado del griego o paralelo al mismo. [54] : 28
El símbolo químico estándar del antimonio (Sb) se atribuye a Jöns Jakob Berzelius , quien derivó la abreviatura de stibium . [55]
Las palabras antiguas para antimonio en su mayoría tienen como significado principal kohl , el sulfuro de antimonio. [56]
Los egipcios llamaban al antimonio mśdmt [57] : 230 [58] : 541 o stm . [59]
La palabra árabe para la sustancia, en oposición al cosmético, puede aparecer como إثمد ithmid, athmoud, othmod o uthmod . Littré sugiere que la primera forma, que es la más antigua, deriva de stimmida , un acusativo de stimmi . [54] [60] La palabra griega στίμμι (stimmi) es utilizada por los poetas trágicos áticos del siglo V a. C., y es posiblemente un préstamo del árabe o del egipcio stm . [59]
La extracción de antimonio de los minerales depende de la calidad y la composición del mineral. La mayor parte del antimonio se extrae en forma de sulfuro; los minerales de menor calidad se concentran mediante flotación por espuma , mientras que los minerales de mayor calidad se calientan a 500–600 °C, la temperatura a la que la estibina se funde y se separa de los minerales de ganga . El antimonio se puede aislar del sulfuro de antimonio crudo mediante reducción con chatarra de hierro: [61]
El sulfuro se convierte en óxido mediante calcinación. El producto se purifica aún más mediante la vaporización del óxido volátil de antimonio (III), que se recupera. [30] Este sublimado se utiliza a menudo directamente para las principales aplicaciones, siendo las impurezas arsénico y sulfuro. [62] [63] El antimonio se aísla del óxido mediante una reducción carbotérmica: [61] [62]
Los minerales de menor calidad se reducen en altos hornos, mientras que los minerales de mayor calidad se reducen en hornos de reverbero . [61]
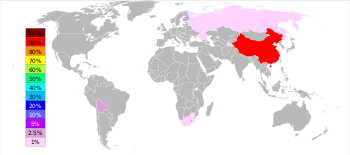

En 2022, según el Servicio Geológico de Estados Unidos , China representó el 54,5% de la producción total de antimonio, seguida en segundo lugar por Rusia con el 18,2% y Tayikistán con el 15,5%. [64]
Se espera que la producción china de antimonio disminuya en el futuro, ya que el gobierno cerrará minas y fundiciones como parte del control de la contaminación. En particular, debido a que en enero de 2015 entró en vigor una ley de protección ambiental [65] y a que entraron en vigor las "Normas de emisión de contaminantes para el estaño, el antimonio y el mercurio" revisadas, los obstáculos para la producción económica son mayores.
Según el informe de Roskill, la producción de antimonio en China ha disminuido y es poco probable que aumente en los próximos años. Hace unos diez años que no se explotan yacimientos importantes de antimonio en China y las reservas económicas restantes se están agotando rápidamente. [66]
En el caso de las regiones importadoras de antimonio, como Europa y los Estados Unidos, se considera que este mineral es fundamental para la fabricación industrial y corre el riesgo de sufrir interrupciones en la cadena de suministro. Dado que la producción mundial proviene principalmente de China (74 %), Tayikistán (8 %) y Rusia (4 %), estas fuentes son fundamentales para el suministro. [67] [68]
Aproximadamente el 48% del antimonio se consume en retardantes de llama , el 33% en baterías de plomo-ácido y el 8% en plásticos. [61]
El antimonio se utiliza principalmente como trióxido para compuestos ignífugos , siempre en combinación con retardantes de llama halogenados, excepto en polímeros que contienen halógenos. El efecto retardante de llama del trióxido de antimonio se produce por la formación de compuestos de antimonio halogenados, [73] que reaccionan con átomos de hidrógeno, y probablemente también con átomos de oxígeno y radicales OH, inhibiendo así el fuego. [74] Los mercados para estos retardantes de llama incluyen ropa para niños, juguetes, aviones y fundas de asientos de automóviles. También se añaden a resinas de poliéster en compuestos de fibra de vidrio para artículos tales como cubiertas de motores de aviones ligeros. La resina arderá en presencia de una llama generada externamente, pero se extinguirá cuando se elimine la llama externa. [30] [75]
El antimonio forma una aleación muy útil con el plomo, aumentando su dureza y resistencia mecánica. Al fundir, aumenta la fluidez de la masa fundida y reduce la contracción durante el enfriamiento. [76] Para la mayoría de las aplicaciones que involucran plomo, se utilizan cantidades variables de antimonio como metal de aleación. En las baterías de plomo-ácido , esta adición mejora la resistencia de la placa y las características de carga. [30] [77] Para los veleros, se utilizan quillas de plomo para proporcionar un momento adrizante, que varía de 600 libras a más de 200 toneladas para los superyates de vela más grandes; para mejorar la dureza y la resistencia a la tracción de la quilla de plomo, el antimonio se mezcla con plomo entre un 2% y un 5% en volumen. El antimonio se utiliza en aleaciones antifricción (como el metal Babbitt ), [78] en balas y perdigones de plomo , revestimientos de cables eléctricos , metal tipográfico (por ejemplo, para máquinas de impresión linotipia [79] ), soldaduras (algunas soldaduras " sin plomo " contienen un 5% de Sb), [80] en peltre , [81] y en aleaciones de endurecimiento con bajo contenido de estaño en la fabricación de tubos de órgano .

Otras tres aplicaciones consumen casi todo el suministro mundial. [61] Una aplicación es como estabilizador y catalizador para la producción de tereftalato de polietileno . [61] Otra es como agente clarificante para eliminar burbujas microscópicas en el vidrio, principalmente para pantallas de televisión [82] – los iones de antimonio interactúan con el oxígeno, suprimiendo la tendencia de este último a formar burbujas. [83] La tercera aplicación son los pigmentos. [61]
En la década de 1990, el antimonio se utilizaba cada vez más en semiconductores como dopante en obleas de silicio de tipo n [84] para diodos , detectores infrarrojos y dispositivos de efecto Hall . En la década de 1950, los emisores y colectores de transistores de unión de aleación npn se doparon con pequeñas perlas de una aleación de plomo y antimonio. [85] El antimoniuro de indio (InSb) se utiliza como material para detectores de infrarrojo medio . [86] [87] [88]
El material Ge2Sb2Te5 se utiliza para la memoria de cambio de fase , un tipo de memoria de computadora .
La biología y la medicina tienen pocos usos para el antimonio. Los tratamientos que contienen antimonio, conocidos como antimoniales , se utilizan como eméticos . [89] Los compuestos de antimonio se utilizan como fármacos antiprotozoarios . El tartrato de antimonilo de potasio , o emético tártaro, se utilizó alguna vez como fármaco antiesquistosómico a partir de 1919. Posteriormente fue reemplazado por praziquantel . [90] El antimonio y sus compuestos se utilizan en varias preparaciones veterinarias , como la antiomalina y el tiomalato de antimonio de litio, como acondicionador de la piel en rumiantes . [91] El antimonio tiene un efecto nutritivo o acondicionador sobre los tejidos queratinizados de los animales.
Los fármacos a base de antimonio, como el antimoniato de meglumina , también se consideran los fármacos de elección para el tratamiento de la leishmaniasis . Los primeros tratamientos utilizaban especies de antimonio(III) (antimoniales trivalentes), pero en 1922 Upendranath Brahmachari inventó un fármaco de antimonio(V) mucho más seguro, y desde entonces los denominados antimoniales pentavalentes han sido el tratamiento estándar de primera línea. Sin embargo, las cepas de Leishmania en Bihar y regiones vecinas han desarrollado resistencia al antimonio. [92] El antimonio elemental en forma de píldora de antimonio se utilizó alguna vez como medicamento. Otros podían reutilizarlo después de la ingestión y eliminación. [93]
El sulfuro de antimonio (III) se utiliza en las cabezas de algunas cerillas de seguridad . [94] [95] Los sulfuros de antimonio ayudan a estabilizar el coeficiente de fricción en los materiales de las pastillas de freno de los automóviles. [96] El antimonio se utiliza en balas, trazadores de balas, [97] pintura, arte en vidrio y como opacificante en el esmalte . El antimonio-124 se utiliza junto con el berilio en fuentes de neutrones ; los rayos gamma emitidos por el antimonio-124 inician la fotodesintegración del berilio. [98] [99] Los neutrones emitidos tienen una energía media de 24 keV. [100] El antimonio natural se utiliza en fuentes de neutrones de arranque .
El polvo derivado del sulfuro de antimonio triturado ( kohl ) se ha utilizado durante milenios como cosmético para los ojos. Históricamente, se aplicaba en los ojos con una varilla de metal y con saliva, y los antiguos creían que ayudaba a curar las infecciones oculares. [101] La práctica todavía se observa en Yemen y en otros países musulmanes. [102]
El antimonio y muchos de sus compuestos son tóxicos y los efectos del envenenamiento por antimonio son similares a los del envenenamiento por arsénico . La toxicidad del antimonio es mucho menor que la del arsénico; esto podría deberse a las diferencias significativas de absorción, metabolismo y excreción entre el arsénico y el antimonio. La absorción de antimonio (III) o antimonio (V) en el tracto gastrointestinal es como máximo del 20%. El antimonio (V) no se reduce cuantitativamente a antimonio (III) en la célula (de hecho, el antimonio (III) se oxida a antimonio (V) en su lugar [103] ).
Como no se produce metilación del antimonio, la excreción de antimonio (V) en la orina es la principal vía de eliminación. [104] Al igual que el arsénico, el efecto más grave de la intoxicación aguda por antimonio es la cardiotoxicidad y la miocarditis resultante ; sin embargo, también puede manifestarse como síndrome de Adams-Stokes , que no ocurre con el arsénico. Se ha informado de casos notificados de intoxicación por antimonio equivalente a 90 mg de tartrato de antimonio y potasio disuelto del esmalte que muestran solo efectos a corto plazo. Se informó de que una intoxicación con 6 g de tartrato de antimonio y potasio resultó en la muerte después de tres días. [105]
La inhalación de polvo de antimonio es nociva y en ciertos casos puede ser mortal; en pequeñas dosis, el antimonio causa dolores de cabeza, mareos y depresión. Dosis mayores, como el contacto prolongado con la piel, pueden causar dermatitis o dañar los riñones y el hígado, causando vómitos violentos y frecuentes, que conducen a la muerte en pocos días. [106]
El antimonio es incompatible con agentes oxidantes fuertes , ácidos fuertes , ácidos halógenos , cloro o flúor . Debe mantenerse alejado del calor. [107]
El antimonio se filtra desde las botellas de tereftalato de polietileno (PET) a los líquidos. [108] Si bien los niveles observados para el agua embotellada están por debajo de las pautas para el agua potable , [109] se encontró que los concentrados de jugo de frutas (para los cuales no se han establecido pautas) producidos en el Reino Unido contenían hasta 44,7 μg/L de antimonio, muy por encima de los límites de la UE para el agua del grifo de 5 μg/L. [110] Las pautas son:
La ingesta diaria tolerable (IDT) propuesta por la OMS es de 6 μg de antimonio por kilogramo de peso corporal. [111] El valor inmediatamente peligroso para la vida o la salud (IDLH) para el antimonio es de 50 mg/m 3 . [114]
Ciertos compuestos de antimonio parecen ser tóxicos, en particular el trióxido de antimonio y el tartrato de antimonio y potasio. [115] Los efectos pueden ser similares a los del envenenamiento por arsénico . [116] La exposición ocupacional puede causar irritación respiratoria, neumoconiosis , manchas de antimonio en la piel, síntomas gastrointestinales y arritmias cardíacas. Además, el trióxido de antimonio es potencialmente cancerígeno para los humanos. [117]
Se han observado efectos adversos para la salud en humanos y animales tras la exposición por inhalación, oral o dérmica al antimonio y a sus compuestos. [115] La toxicidad del antimonio suele producirse debido a la exposición ocupacional, durante la terapia o por ingestión accidental. No está claro si el antimonio puede entrar en el cuerpo a través de la piel. [115] La presencia de niveles bajos de antimonio en la saliva también puede estar asociada con la caries dental . [118]