Un indicador de pH es un compuesto químico halocrómico añadido en pequeñas cantidades a una solución para que el pH ( acidez o basicidad ) de la solución se pueda determinar visualmente o espectroscópicamente mediante cambios en las propiedades de absorción y/o emisión. [1] Por lo tanto, un indicador de pH es un detector químico de iones hidronio (H 3 O + ) o iones hidrógeno (H + ) en el modelo de Arrhenius .
Normalmente, el indicador hace que el color de la solución cambie dependiendo del pH. Los indicadores también pueden mostrar cambios en otras propiedades físicas; por ejemplo, los indicadores olfativos muestran cambios en su olor . El valor de pH de una solución neutra es 7.0 a 25°C ( condiciones estándar de laboratorio ). Las soluciones con un valor de pH inferior a 7.0 se consideran ácidas y las soluciones con un valor de pH superior a 7.0 son básicas. Dado que la mayoría de los compuestos orgánicos naturales son electrolitos débiles , como los ácidos carboxílicos y las aminas , los indicadores de pH encuentran muchas aplicaciones en biología y química analítica . Además, los indicadores de pH forman uno de los tres tipos principales de compuestos indicadores utilizados en el análisis químico. Para el análisis cuantitativo de cationes metálicos, se prefiere el uso de indicadores complexométricos , [2] [3] mientras que la tercera clase de compuestos, los indicadores redox , se utilizan en titulaciones redox ( titulaciones que implican una o más reacciones redox como base del análisis químico).
Los indicadores de pH suelen ser, por sí mismos, ácidos o bases débiles. El esquema general de reacción de los indicadores de pH ácidos en soluciones acuosas se puede formular de la siguiente manera:
donde, "HInd" es la forma ácida y "Ind − " es la base conjugada del indicador.
Viceversa para los indicadores básicos de pH en soluciones acuosas:
donde "IndOH" representa la forma básica e "Ind + " el ácido conjugado del indicador.
La relación entre la concentración de ácido/base conjugado y la concentración del indicador ácido/básico determina el pH (o pOH) de la solución y relaciona el color con el valor de pH (o pOH). Para los indicadores de pH que son electrolitos débiles, la ecuación de Henderson-Hasselbalch se puede escribir de la siguiente manera:
Las ecuaciones, derivadas de la constante de acidez y la constante de basicidad, establecen que cuando el pH es igual al valor p K a o p K b del indicador, ambas especies están presentes en una proporción de 1:1. Si el pH es superior al valor p K a o p K b , la concentración de la base conjugada es mayor que la concentración del ácido y predomina el color asociado a la base conjugada. Si el pH es inferior al valor p K a o p K b , ocurre lo contrario.
Por lo general, el cambio de color no es instantáneo en el valor p K a o p K b , sino que existe un rango de pH en el que está presente una mezcla de colores. Este rango de pH varía entre indicadores, pero como regla general, se encuentra entre el valor p K a o p K b más o menos uno. Esto supone que las soluciones conservan su color mientras persista al menos el 10% de las otras especies. Por ejemplo, si la concentración de la base conjugada es 10 veces mayor que la concentración del ácido, su relación es 10:1 y, en consecuencia, el pH es p K a + 1 o p K b + 1. Por el contrario, si se produce un exceso de 10 veces del ácido con respecto a la base, la relación es 1:10 y el pH es p K a − 1 o p K b − 1.
Para lograr una precisión óptima, la diferencia de color entre las dos especies debe ser lo más clara posible y cuanto más estrecho sea el rango de pH del cambio de color, mejor. En algunos indicadores, como la fenolftaleína , una de las especies es incolora, mientras que en otros, como el rojo de metilo , ambas especies confieren un color. Si bien los indicadores de pH funcionan de manera eficiente en su rango de pH designado, generalmente se destruyen en los extremos de la escala de pH debido a reacciones secundarias no deseadas.

Los indicadores de pH se emplean con frecuencia en titulaciones en química analítica y biología para determinar el alcance de una reacción química . [1] Debido a la elección subjetiva (determinación) del color, los indicadores de pH son susceptibles a lecturas imprecisas. Para aplicaciones que requieren una medición precisa del pH, se utiliza con frecuencia un medidor de pH . A veces, se utiliza una combinación de diferentes indicadores para lograr varios cambios de color suaves en un amplio rango de valores de pH. Estos indicadores comerciales (por ejemplo, el indicador universal y los papeles Hydrion ) se utilizan cuando solo se necesita un conocimiento aproximado del pH. Para una titulación, la diferencia entre el punto final real y el punto final indicado se denomina error del indicador. [1]
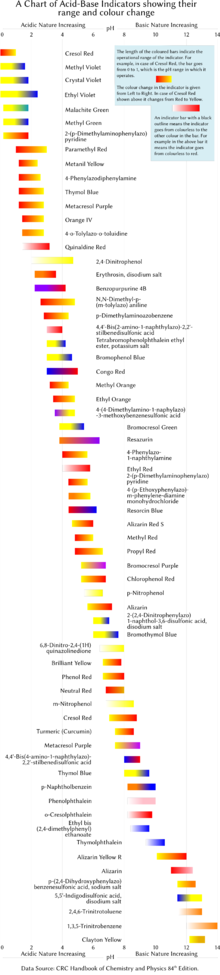
A continuación se muestran en una tabla varios indicadores de pH de laboratorio comunes. Los indicadores suelen presentar colores intermedios en valores de pH dentro del rango de transición indicado. Por ejemplo, el rojo de fenol presenta un color naranja entre pH 6,8 y pH 8,4. El rango de transición puede variar ligeramente según la concentración del indicador en la solución y la temperatura a la que se utilice. La figura de la derecha muestra los indicadores con su rango de funcionamiento y los cambios de color.

Se puede utilizar un indicador para obtener mediciones bastante precisas del pH midiendo cuantitativamente la absorbancia en dos o más longitudes de onda. El principio se puede ilustrar tomando como indicador un ácido simple, HA, que se disocia en H + y A− .
Se debe conocer el valor de la constante de disociación ácida , p K a . Las absorbancias molares , ε HA y ε A − de las dos especies HA y A − en las longitudes de onda λ x y λ y también se deben haber determinado mediante un experimento previo. Suponiendo que se cumple la ley de Beer , las absorbancias medidas A x y A y en las dos longitudes de onda son simplemente la suma de las absorbancias debidas a cada especie.
Se trata de dos ecuaciones en las dos concentraciones [HA] y [A − ]. Una vez resueltas, el pH se obtiene como
Si se realizan mediciones en más de dos longitudes de onda, las concentraciones [HA] y [A − ] se pueden calcular mediante mínimos cuadrados lineales . De hecho, se puede utilizar un espectro completo para este propósito. El proceso se ilustra para el indicador verde de bromocresol . El espectro observado (verde) es la suma de los espectros de HA (oro) y de A − (azul), ponderados por la concentración de las dos especies.
Cuando se utiliza un solo indicador, este método se limita a mediciones en el rango de pH p K a ± 1, pero este rango se puede ampliar utilizando mezclas de dos o más indicadores. Debido a que los indicadores tienen espectros de absorción intensos, la concentración del indicador es relativamente baja y se supone que el indicador en sí tiene un efecto insignificante en el pH.
En las titulaciones ácido-base, un indicador de pH inadecuado puede inducir un cambio de color en la solución que contiene el indicador antes o después del punto de equivalencia real. Como resultado, se pueden concluir diferentes puntos de equivalencia para una solución en función del indicador de pH utilizado. Esto se debe a que el más mínimo cambio de color de la solución que contiene el indicador sugiere que se ha alcanzado el punto de equivalencia. Por lo tanto, el indicador de pH más adecuado tiene un rango de pH efectivo, donde el cambio de color es evidente, que abarca el pH del punto de equivalencia de la solución que se está titulando. [5]
Muchas plantas o partes de plantas contienen sustancias químicas de la familia de compuestos de color natural de las antocianinas . Son rojas en soluciones ácidas y azules en básicas. Las antocianinas se pueden extraer con agua u otros disolventes de una multitud de plantas y partes de plantas coloreadas, incluidas las hojas ( col lombarda ); flores ( geranio , amapola o pétalos de rosa ); bayas ( arándanos , grosella negra ); y tallos ( ruibarbo ). La extracción de antocianinas de plantas domésticas, especialmente de la col lombarda , para formar un indicador de pH crudo es una demostración introductoria popular de química.
El tornasol , utilizado por los alquimistas en la Edad Media y que todavía se consigue fácilmente, es un indicador de pH natural elaborado a partir de una mezcla de especies de líquenes , en particular Roccella tinctoria . La palabra tornasol proviene literalmente de "musgo coloreado" en nórdico antiguo (véase Litr ). El color cambia entre rojo en soluciones ácidas y azul en álcalis. El término "prueba de tornasol" se ha convertido en una metáfora ampliamente utilizada para cualquier prueba que pretenda distinguir con autoridad entre alternativas.
Las flores de la Hydrangea macrophylla pueden cambiar de color según la acidez del suelo. En suelos ácidos, se producen reacciones químicas en el suelo que hacen que el aluminio esté disponible para estas plantas, volviéndose azules las flores. En suelos alcalinos, estas reacciones no pueden ocurrir y, por lo tanto, la planta no absorbe el aluminio. Como resultado, las flores permanecen rosadas.
Otro indicador natural de pH es la cúrcuma , una especia que se torna amarilla cuando se expone a ácidos y marrón rojiza cuando está en presencia de álcalis .