La oxidación de alcohol es un conjunto de reacciones de oxidación en química orgánica que convierten alcoholes en aldehídos , cetonas , ácidos carboxílicos y ésteres donde el carbono lleva un estado de oxidación más alto . La reacción se aplica principalmente a alcoholes primarios y secundarios. Los alcoholes secundarios forman cetonas, mientras que los alcoholes primarios forman aldehídos o ácidos carboxílicos. [1]
La reacción puede ocurrir usando una variedad de oxidantes.

En principio, una forma sencilla de oxidar alcoholes utiliza un átomo de oxígeno y produce agua: en la práctica, los átomos de oxígeno no están disponibles, por lo que la ecuación anterior es sólo conceptual. En cambio, la mayoría de las oxidaciones utilizan reactivos a base de óxidos, como oxocomplejos metálicos , sulfóxidos y óxidos de yodo.
A través de una variedad de mecanismos, la eliminación de un equivalente de hidruro convierte un alcohol primario o secundario en un aldehído o cetona, respectivamente. La oxidación de alcoholes primarios a ácidos carboxílicos normalmente se realiza a través del aldehído correspondiente, que se transforma mediante un hidrato de aldehído ( gem -diol, R-CH(OH) 2 ) mediante reacción con agua. Por tanto, la oxidación de un alcohol primario a nivel de aldehído sin oxidación adicional al ácido carboxílico es posible realizando la reacción en ausencia de agua, de modo que no se pueda formar ningún hidrato de aldehído.

Muchos reactivos oxidan alcoholes secundarios a cetonas y alcoholes primarios a aldehídos. Los alcoholes alílicos y bencílicos representan casos especiales. Los aldehídos son susceptibles a una sobreoxidación a ácidos carboxílicos.

Para estas oxidaciones se utilizan habitualmente reactivos de cromo (VI). Una familia de reactivos de Cr(VI) emplea el complejo CrO 3 (piridina) 2 . [2]
Una segunda familia de reactivos de Cr(VI) son las sales , que presentan el catión piridinio (C 5 H 5 NH + ).
Estas sales son menos reactivas, más fáciles de manipular y más selectivas que el reactivo de Collins en las oxidaciones de alcoholes.
Los reactivos anteriores representan mejoras con respecto al antiguo reactivo de Jones , una solución de trióxido de cromo en ácido sulfúrico acuoso .
El periodinano de Dess-Martin es un oxidante suave para la conversión de alcoholes en aldehídos o cetonas. [4] La reacción se realiza en condiciones estándar, a temperatura ambiente, generalmente en diclorometano . La reacción tarda entre media hora y dos horas en completarse. Luego se separa el producto del periodinano gastado. [5] Se han desarrollado muchos oxidantes a base de yodosilo, por ejemplo, IBX .
La oxidación Swern utiliza cloruro de oxalilo , dimetilsulfóxido y una base orgánica, como la trietilamina .
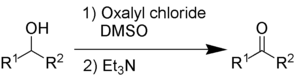
Los subproductos son sulfuro de dimetilo (Me 2 S), monóxido de carbono (CO), dióxido de carbono (CO 2 ) y, cuando se utiliza trietilamina como base, cloruro de trietilamonio (C 6 H 15 NHCl).
Este método poco utilizado interconvierte alcoholes y carbonilos.
La oxidación Ley utiliza NMO como oxidante estequiométrico con perrutenato de tetrapropilamonio como catalizador.
La oxidación de Fétizon , también un método poco utilizado, utiliza carbonato de plata soportado sobre Celita. Este reactivo opera mediante oxidación de un solo electrón por parte de cationes de plata.
Otro método es la oxidación catalizada por oxoamonio .
Además, se ha informado que el hipoclorito de sodio (o lejía doméstica) en acetona produce una conversión eficiente de alcoholes secundarios en presencia de alcoholes primarios (oxidación de Stevens). [6]
Los complejos de metales de transición solubles catalizan la oxidación de alcoholes por la presencia de dioxígeno u otro oxidante terminal. [7]

Los compuestos que poseen dos grupos hidroxi ubicados en carbonos adyacentes, es decir, dioles vecinales/1,2- dioles , sufren rotura oxidativa en un enlace carbono-carbono con algunos oxidantes como el periodato de sodio (NaIO 4 ), (diacetoxiyodo)benceno (PhI( OAc) 2 ) [8] o tetraacetato de plomo (Pb(OAc) 4 ), lo que da como resultado la generación de dos grupos carbonilo . La reacción también se conoce como escisión de glicol .

Cuando un alcohol primario se convierte en un ácido carboxílico , el átomo de carbono terminal aumenta en cuatro su estado de oxidación . La oxidación directa de alcoholes primarios a ácidos carboxílicos se puede llevar a cabo utilizando diversos reactivos.
Los aldehídos se oxidan fácilmente utilizando reactivos de Cr(VI) y Mn(VII) a ácidos carboxílicos.
El permanganato de potasio (KMnO 4 ) oxida los alcoholes primarios a ácidos carboxílicos de manera muy eficiente. Esta reacción, que fue descrita en detalle por primera vez por Fournier, [9] [10] normalmente se lleva a cabo añadiendo KMnO 4 a una solución o suspensión del alcohol en una solución acuosa alcalina. Para que la reacción se desarrolle de manera eficiente, el alcohol debe estar al menos parcialmente disuelto en la solución acuosa. Esto puede facilitarse mediante la adición de un codisolvente orgánico como dioxano , piridina , acetona o t -BuOH . El KMnO 4 reacciona con muchos grupos funcionales , como alcoholes secundarios, 1,2-dioles, aldehídos, alquenos, oximas, sulfuros y tioles, y dobles enlaces carbono-carbono. Por tanto, la selectividad es un problema.

El llamado reactivo de Jones , preparado a partir de trióxido de cromo (CrO 3 ) y ácido sulfúrico acuoso , oxida los alcoholes a ácido carboxílico. El protocolo proporciona frecuentemente cantidades sustanciales de ésteres . [12] Los problemas son la toxicidad y la hostilidad ambiental del reactivo. Se han descrito variantes catalíticas que implican un tratamiento con exceso de ácido periódico (H 5 IO 6 ). [13]

Como muchas de las condiciones antes mencionadas para la oxidación de alcoholes primarios a ácidos son duras y no compatibles con los grupos protectores comunes, los químicos orgánicos suelen utilizar un procedimiento de dos pasos para la oxidación a ácidos. El alcohol se oxida a un aldehído mediante uno de los muchos procedimientos anteriores. Esta secuencia se utiliza a menudo en la síntesis de productos naturales como en la síntesis de platencina. [15]
El tetróxido de rutenio es un agente agresivo, poco utilizado, que permite condiciones de reacción suaves.
Oxidación de Heyn. [dieciséis]
El uso de cloritos como oxidantes terminales junto con hipocloritos y TEMPO proporciona ácidos carboxílicos sin productos secundarios de la cloración. [17] La reacción suele realizarse en dos pasos en el mismo recipiente: se realiza una oxidación parcial con TEMPO e hipoclorito, luego se añade clorito para completar la oxidación. Sólo se observa oxidación de alcohol primario. Junto con la dihidroxilación de Sharpless, este método se puede utilizar para generar α-hidroxiácidos enantiopuros. [18]
La oxidación de Pinnick utiliza clorito de sodio . [19]