Un oogonio ( pl.: oogonia ) es una pequeña célula diploide que, al madurar, forma un folículo primordial en un feto femenino o en el gametangio femenino (haploide o diploide) de ciertos talófitos .
Las ovogonias se forman en grandes cantidades por mitosis en las primeras etapas del desarrollo fetal a partir de células germinales primordiales . En humanos comienzan a desarrollarse entre las semanas 4 y 8 y están presentes en el feto entre las semanas 5 y 30.
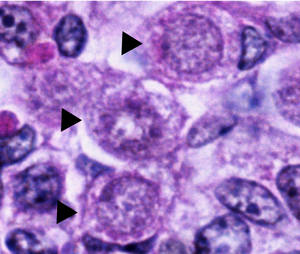
Las ovogonías normales en los ovarios humanos tienen forma esférica u ovoide y se encuentran entre células somáticas vecinas y ovocitos en diferentes fases de desarrollo. Las ovogonias se pueden distinguir de las células somáticas vecinas, bajo un microscopio electrónico , observando sus núcleos . Los núcleos oogoniales contienen material fibrilar y granular disperso aleatoriamente, mientras que las células somáticas tienen un núcleo más condensado que crea un contorno más oscuro bajo el microscopio. Los núcleos oogoniales también contienen nucléolos densos y prominentes . El material cromosómico en el núcleo de las oogonias que se dividen mitóticamente se muestra como una masa densa rodeada de vesículas o membranas dobles. [1]
El citoplasma de las oogonias parece similar al de las células somáticas circundantes y de manera similar contiene grandes mitocondrias redondas con crestas laterales . Sin embargo, el retículo endoplásmico (RE) de las oogonias está muy poco desarrollado y está formado por varias vesículas pequeñas. Algunas de estas pequeñas vesículas contienen cisternas con ribosomas y se encuentran ubicadas cerca del aparato de Golgi . [1]
Las ovogonias que están sufriendo degeneración se ven ligeramente diferentes bajo el microscopio electrónico. En estas oogonias, los cromosomas se agrupan en una masa indistinguible dentro del núcleo y las mitocondrias y el RE parecen estar hinchados y alterados. Las oogonias degeneradas generalmente se encuentran parcial o totalmente envueltas en células somáticas vecinas, identificándose la fagocitosis como el modo de eliminación. [1]
En el blastocisto del embrión de mamífero , las células germinales primordiales surgen de los epiblastos proximales bajo la influencia de señales extraembrionarias. Estas células germinales luego viajan, mediante movimiento ameboide, hasta la cresta genital y, finalmente, hacia las gónadas indiferenciadas del feto. [2] Durante la cuarta o quinta semana de desarrollo, las gónadas comienzan a diferenciarse. En ausencia del cromosoma Y, las gónadas se diferenciarán en ovarios. A medida que los ovarios se diferencian, se desarrollan crecimientos internos llamados cordones corticales. Aquí es donde se acumulan las células germinales primordiales. [3] [4]
Durante la sexta a octava semana del desarrollo embrionario femenino (XX), las células germinales primordiales crecen y comienzan a diferenciarse en oogonias. Las oogonias proliferan mediante mitosis durante la semana 9 a la 22 del desarrollo embrionario. Puede haber hasta 600.000 oogonias en la octava semana de desarrollo y hasta 7.000.000 en el quinto mes. [3]
Con el tiempo, las ovogonias degenerarán o se diferenciarán aún más en ovocitos primarios mediante división asimétrica. La división asimétrica es un proceso de mitosis en el que un oogonio se divide de manera desigual para producir una célula hija que eventualmente se convertirá en un ovocito mediante el proceso de oogénesis , y una célula hija que es un oogonio idéntico a la célula madre. Esto ocurre durante la semana 15 al 7º mes de desarrollo embrionario. [2] La mayoría de las ovogonias han degenerado o diferenciado en ovocitos primarios al nacer. [3] [5]
Los ovocitos primarios sufrirán una ovogénesis en la que entrarán en meiosis . Sin embargo, los ovocitos primarios se detienen en la profase 1 de la primera meiosis y permanecen en esa etapa detenida hasta que comienza la pubertad en la mujer adulta. [6] Esto contrasta con las células germinales primordiales masculinas que se detienen en la etapa espermatogonial al nacer y no entran en la espermatogénesis y la meiosis para producir espermatocitos primarios hasta la pubertad en el varón adulto. [3]
La regulación y diferenciación de las células germinales en gametocitos primarios depende en última instancia del sexo del embrión y de la diferenciación de las gónadas. En ratones hembra, la proteína RSPO1 es responsable de la diferenciación de las gónadas femeninas (XX) en ovarios . RSPO1 activa la vía de señalización de β-catenina regulando positivamente Wnt4 , que es un paso esencial en la diferenciación de los ovarios. Las investigaciones han demostrado que los ovarios que carecen de Rspo1 o Wnt4 exhibirán inversión sexual de las gónadas, la formación de ovotestes y la diferenciación de células somáticas de Sertoli , que ayudan en el desarrollo de los espermatozoides . [4]
Después de que las células germinales femeninas (XX) se acumulan en las gónadas indiferenciadas, se requiere la regulación positiva de Stra8 para la diferenciación de las células germinales en un oogonio y finalmente entren en la meiosis. Un factor importante que contribuye a la regulación positiva de Stra8 es el inicio de la vía de señalización de β-catenina a través de RSPO1, que también es responsable de la diferenciación de los ovarios. Dado que RSPO1 se produce en células somáticas, esta proteína actúa sobre las células germinales de forma paracrina . Rspo1 , sin embargo, no es el único factor en la regulación de Stra8 . Muchos otros factores están bajo escrutinio y este proceso aún se está evaluando. [4]
Se teoriza que las oogonias degeneran o se diferencian en ovocitos primarios que entran en la oogénesis y se detienen en la profase I de la primera meiosis posparto. Por tanto, se cree que las hembras adultas de mamíferos carecen de una población de células germinales que puedan renovarse o regenerarse, y en cambio tienen una gran población de ovocitos primarios que son detenidos en la primera meiosis hasta la pubertad . [2] En la pubertad, un ovocito primario continuará la meiosis en cada ciclo menstrual . Debido a la ausencia de células germinales en regeneración y oogonias en el ser humano, el número de ovocitos primarios disminuye después de cada ciclo menstrual hasta la menopausia , cuando la mujer ya no tiene una población de ovocitos primarios. [2]
Sin embargo, investigaciones recientes han identificado que puede haber oogonias renovables en el revestimiento de los ovarios femeninos de humanos, primates y ratones. [2] [7] [8] Se cree que estas células germinales podrían ser necesarias para el mantenimiento de los folículos reproductivos y el desarrollo de los ovocitos, hasta bien entrada la edad adulta. También se ha descubierto que algunas células madre pueden migrar desde la médula ósea a los ovarios como fuente de células germinales extrageniales. Estas células germinales mitóticamente activas que se encuentran en mamíferos adultos se identificaron mediante el seguimiento de varios marcadores que eran comunes en los ovocitos. Estas células germinales potencialmente renovables se identificaron como positivas para estos marcadores de ovocitos esenciales. [2]
El descubrimiento de estas células germinales activas y oogonias en la mujer adulta podría ser muy útil en el avance de la investigación sobre fertilidad y el tratamiento de la infertilidad. [2] [8] Las células germinales se han extraído, aislado y cultivado con éxito in vitro . [8] Estas células germinales se han utilizado para restaurar la fertilidad en ratones al promover la generación y el mantenimiento de folículos en ratones previamente infértiles. También se están realizando investigaciones sobre la posible regeneración de la línea germinal en primates. Las células germinales femeninas humanas mitóticamente activas podrían ser muy beneficiosas para un nuevo método de desarrollo de células madre embrionarias que implica una transferencia nuclear a un cigoto . El uso de estas oogonias funcionales puede ayudar a crear líneas de células madre específicas para cada paciente mediante este método. [2]
Existe una importante controversia sobre la existencia de células madre oogoniales de mamíferos. La controversia radica en los datos negativos que se han originado en muchos laboratorios de Estados Unidos. Múltiples enfoques para verificar la existencia de células madre oogoniales han arrojado resultados negativos y ningún grupo de investigación en Estados Unidos ha podido reproducir los hallazgos iniciales. [9] [10] [11]
.jpg/440px-Oogonium_--_3_(34809275943).jpg)
En psicología y micología , oogonio se refiere a un gametangio femenino si la unión del gameto masculino (móvil o inmóvil) y el femenino se produce dentro de esta estructura. [12] [13]
En Oomycota y algunos otros organismos, las oogonias femeninas y los anteridios equivalentes masculinos son el resultado de la esporulación sexual, es decir, el desarrollo de estructuras dentro de las cuales se producirá la meiosis. Los núcleos haploides (gametos) se forman por meiosis dentro de los anteridios y oogonias, y cuando se produce la fertilización, se produce una oospora diploide que eventualmente germinará en la etapa somática diploide del ciclo de vida del talófito. [14]
En muchas algas (p. ej., Chara ), la planta principal es haploide; Se forman oogonias y anteridios y producen gametos haploides. La única parte diploide del ciclo de vida es la espora (óvulo fertilizado), que sufre meiosis para formar células haploides que se convierten en nuevas plantas. Este es un ciclo de vida haplontico (con meiosis cigótica ).
Las oogonias de ciertas especies de Talófitos [ ¿cuáles? ] suelen ser redondos u ovoides, con contenidos divididos en varias oosferas uninucleadas . Esto contrasta con los anteridios masculinos, que son alargados y contienen varios núcleos. [14]
En especies heterotálicas , las oogonias y los anteridios se ubican en ramas hifales de diferentes colonias de talófitos. Los oogonia de esta especie sólo pueden ser fertilizados por anteridios de otra colonia y aseguran que la autofecundación sea imposible. [ aclaración necesaria ] Por el contrario, las especies homotálicas muestran las oogonias y los anteridios en la misma rama de las hifas o en ramas de las hifas separadas pero dentro de la misma colonia. [14]
En un modo común de fertilización que se encuentra en ciertas especies de talófitos, los anteridios se unirán a las oogonias. Los anteridios luego formarán tubos de fertilización que conectan el citoplasma de los anteridios con cada oosfera dentro de la oogonia. Luego, un núcleo haploide (gameto) del anteridio se transferirá a través del tubo de fertilización hacia la oosfera y se fusionará con el núcleo haploide de la oosfera formando una oospora diploide. La oospora entonces está lista para germinar y desarrollarse hasta convertirse en una etapa somática diploide adulta. [14]
Lista de distintos tipos de células en el cuerpo humano adulto