Los oligodendrogliomas son un tipo de glioma que se cree que se origina a partir de los oligodendrocitos del cerebro o de una célula precursora glial. Se presentan principalmente en adultos (9,4 % de todos los tumores primarios del cerebro y del sistema nervioso central), pero también se encuentran en niños (4 % de todos los tumores cerebrales primarios).
Los oligodendrogliomas se originan principalmente en el lóbulo frontal y en el 50-80% de los casos, el primer síntoma es el inicio de la actividad convulsiva , sin tener ningún síntoma previo. [2] Los dolores de cabeza combinados con aumento de la presión intracraneal también son un síntoma común del oligodendroglioma. Dependiendo de la ubicación del tumor, se pueden inducir muchos déficits neurológicos y neuropsicológicos diferentes, que incluyen, entre otros, pérdida visual, debilidad motora, deterioro cognitivo y ansiedad . [3] Es necesaria una tomografía computarizada (TC) o una resonancia magnética (RM) para caracterizar el tamaño del tumor, la ubicación y la hetero u homogeneidad. El diagnóstico final se basa en la biopsia y el examen histopatológico de la masa tumoral. [2]
Se desconoce la causa de los oligodendrogliomas. Algunos estudios han relacionado el oligodendroglioma con una causa viral. Un estudio del Oxford Neurosymposium de 2009 ilustró una correlación del 69% entre la mutación del gen NJDS y la iniciación del tumor. [ cita requerida ] Un solo informe de caso ha vinculado el oligodendroglioma con la irradiación del adenoma hipofisario. [ 4 ]

Los oligodendrogliomas no pueden diferenciarse actualmente de otras lesiones cerebrales únicamente por su apariencia clínica o radiográfica. Por ello, la biopsia cerebral es el único método de diagnóstico definitivo. Los oligodendrogliomas recapitulan la apariencia de la oligodendroglia residente normal del cerebro. (Su nombre deriva de las raíces griegas “oligo” que significa “pocos” y “dendro” que significa “árboles”). Generalmente están compuestos de células con núcleos redondos pequeños o ligeramente agrandados con núcleos oscuros y compactos y una pequeña cantidad de citoplasma eosinófilo. A menudo se los denomina células de “huevo frito” debido a su apariencia histológica (aunque el halo perinuclear en las secciones permanentes es un artefacto del secado del tejido; el tejido fresco carece de esta apariencia característica de “huevo frito”). Aparecen como una población monótona de células redondas ligeramente agrandadas que infiltran el parénquima cerebral normal y producen nódulos vagos. Aunque el tumor puede parecer vagamente circunscrito, es por definición un tumor de infiltración difusa. [5]
Clásicamente, tienden a tener una vasculatura de capilares finamente ramificados que pueden adoptar un aspecto de "malla de gallinero". Cuando invaden estructuras de materia gris como la corteza, los oligodendrocitos neoplásicos tienden a agruparse alrededor de las neuronas, lo que muestra un fenómeno conocido como "satellitosis perineuronal". Los oligodendrogliomas pueden invadir preferentemente alrededor de los vasos o debajo de la superficie pial del cerebro. [5]
Los oligodendrogliomas deben diferenciarse del astrocitoma más común . Se observan variantes no clásicas y tumores combinados de diferenciación tanto de oligodendroglioma como de astrocitoma, lo que hace que esta distinción sea controvertida entre diferentes grupos de neuropatología . Los diagnósticos moleculares pueden hacer que esta diferenciación quede obsoleta en el futuro. Aunque, en el tejido cerebral normal, OLIG2 se expresa en oligodendrocitos pero no en astrocitos maduros, se expresa de manera similar tanto en astrocitomas adultos (incluidos tanto astrocitomas difusos con mutación IDH como astrocitomas anaplásicos, así como glioblastomas con IDH de tipo salvaje ) como en oligodendrogliomas. [6] Por lo tanto, OLIG2 no debe usarse para diferenciar estas clases de gliomas adultos, aunque el nivel de expresión podría predecir el estado de mutación de IDH en algunas circunstancias clínicas. [6]
Otros tumores gliales y glioneuronales con los que a menudo se confunden debido a su apariencia monótona de células redondas incluyen el astrocitoma pilocítico , el neurocitoma central , el llamado tumor neuroepitelial disembrioplásico o, ocasionalmente, el ependimoma .
La clasificación histopatológica de los oligodendrogliomas es controvertida. Actualmente, el esquema de clasificación más utilizado se basa en las directrices de la Organización Mundial de la Salud (OMS) del año 2007. Se está elaborando una clasificación actualizada. [7] Los oligodendrogliomas se suelen dividir en tumores de grado II (bajo grado).
Lamentablemente, las directrices de la OMS incluyen criterios subjetivos en el grado II. Además, la presencia de baja actividad mitótica, proliferación vascular y necrosis, incluida la necrosis pseudopallisading, no es suficiente por sí sola para elevar el grado de este tumor. Esto conduce a una inevitable variabilidad interobservador en el diagnóstico por parte de los patólogos. La responsabilidad última de tomar decisiones sobre el tratamiento y la interpretación de este diagnóstico recae en el oncólogo en consulta con el paciente y su familia.
Se ha propuesto que las directrices de la OMS contengan una categoría para los oligodendrogliomas de grado IV, que parecen ser, en esencia, neoplasias gliales con características abrumadoras de glioblastoma multiforme (GBM), que surgen de oligodendrogliomas de grado inferior conocidos o de GBM con una proporción significativa de diferenciación oligodendroglial . La utilidad diagnóstica de esta última categoría es incierta, ya que estos tumores pueden comportarse como un glioblastoma o como oligodendrogliomas anaplásicos de grado III . Por lo tanto, se trata de un diagnóstico excepcionalmente inusual.
Las directrices actualizadas de la OMS publicadas en 2007 recomiendan clasificar por el momento estos tumores como "glioblastoma con componente de oligodendroglioma". [8] Queda por establecer si estos tumores tienen o no un mejor pronóstico que los glioblastomas estándar.
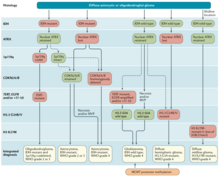
En la clasificación CNS5 de la OMS de 2021, [10] el oligodendroglioma se denomina "Oligodendroglioma, mutante en IDH y con deleción de 1p/19q", y requiere la presencia de mutaciones en IDH1 o IDH2 y la deleción de los brazos cromosómicos 1p y 19q. Curiosamente, el oligodendroglioma tiene una tasa más alta de mutación en IDH2 que el astrocitoma, [6] por lo que el anticuerpo de IHC contra el mutante común p.R132H en IDH1 [11] podría no detectar la mutación.
La deformidad estructural más frecuente es la codeleción de los brazos cromosómicos 1p y 19q. La alta frecuencia de codeleción es una característica sorprendente de este tumor glial y se considera una "firma genética" del oligodendroglioma. Las pérdidas alélicas en 1p y 19q, ya sea por separado o combinadas, son más comunes en los oligodendrogliomas clásicos que en los astrocitomas u oligoastrocitomas. [12] En un estudio, los oligodendrogliomas clásicos mostraron pérdida de 1p en 35 de 42 (83%) casos, pérdida de 19q en 28 de 39 (72%), y estas se combinaron en 27 de 39 (69%) casos; no hubo una diferencia significativa en la pérdida de 1p/19q del estado de heterocigosidad entre el oligodendroglioma de bajo grado y el anaplásico . [12] La codeleción de 1p/19q se ha correlacionado tanto con la quimiosensibilidad como con un mejor pronóstico en oligodendrogliomas. [13] [14] Los productos génicos perdidos como consecuencia de esta codeleción pueden incluir mediadores de resistencia a terapias genotóxicas. Alternativamente, la pérdida de 1p/19q podría ser una lesión oncogénica temprana que promueve la formación de neoplasias gliales, que conservan una alta sensibilidad al estrés genotóxico. La mayoría de los centros de tratamiento del cáncer más grandes verifican rutinariamente la deleción de 1p/19q como parte del informe patológico de oligodendrogliomas. El estado de los loci 1p/19q se puede detectar mediante FISH, análisis de pérdida de heterocigosidad (LOH) o cariotipo virtual . El cariotipo virtual tiene la ventaja de evaluar todo el genoma en un solo ensayo, así como los loci 1p/19q. Esto permite la evaluación de otros loci clave en los tumores gliales, como el estado del número de copias de EGFR y TP53.
Mientras que la relevancia pronóstica de las deleciones 1p y 19q está bien establecida para oligoastrocitomas mixtos, la relevancia pronóstica de las deleciones para gliomas de bajo grado es más controvertida. En términos de gliomas de bajo grado, un estudio reciente también sugiere que la codeleción 1p/19q puede estar asociada con una translocación (1;19)(q10;p10) que, al igual que la deleción combinada 1p/19q, se asocia con una supervivencia general superior y una supervivencia libre de progresión en pacientes con gliomas de bajo grado. [15] Los oligodendrogliomas muestran solo raramente mutaciones en el gen p53, lo que contrasta con otros gliomas. [16] La amplificación del receptor del factor de crecimiento epidérmico y la codeleción completa de 1p/19q son mutuamente excluyentes y predicen resultados completamente diferentes, y la amplificación de EGFR predice un mal pronóstico. [17] Existe una fuerte correlación entre la codeleción 1p/19q y la expresión de genes proneurales, lo que sugiere que los gliomas con una codeleción 1p19q representan un subgrupo de gliomas proneurales. [17]


Los oligodendrogliomas se consideran generalmente incurables con los tratamientos actuales. Sin embargo, en comparación con los astrocitomas más comunes , crecen lentamente y tienen una supervivencia prolongada. En una serie, la mediana de supervivencia de los oligodendrogliomas fue de 11,6 años para el grado II. [18]
Sin embargo, estas cifras pueden ser engañosas, ya que no tienen en cuenta los tipos de tratamiento ni la firma genética de los tumores. Un estudio reciente analizó la supervivencia en función de las deleciones cromosómicas y los efectos de la radioterapia o la quimioterapia como tratamiento, con los siguientes resultados (tanto oligodendrogliomas de bajo grado como anaplásicos): deleción 1p/19q con radioterapia = 121 meses (media), deleción 1p/19q con quimioterapia = más de 160 meses (media aún no alcanzada), sin deleción 1p/19q con radioterapia = 58 meses (media) y sin deleción 1p/19q con quimioterapia = 75 meses (media). [19]
Dada la naturaleza indolente de este tumor y la morbilidad potencial asociada con la neurocirugía , la quimioterapia y la radioterapia , la mayoría de los neurooncólogos inicialmente seguirán un curso de espera vigilante y tratarán a los pacientes sintomáticamente. El tratamiento sintomático a menudo incluye el uso de anticonvulsivos para las convulsiones y esteroides para la inflamación cerebral .
El esquema de dosificación estándar de temozolomida es de cinco días consecutivos de dosificación diaria durante ciclos de 28 días. Sin embargo, diferentes esquemas de dosificación pueden producir mejores resultados, como la dosificación diaria continua utilizando cantidades menores del fármaco (por ejemplo, dosificación de 21 días durante ciclos de 28 días). Como ejemplo de un esquema de dosificación modificado, se han demostrado resultados prometedores utilizando dosis diarias más bajas cada día durante 7 semanas, seguidas de períodos de descanso de 4 semanas. [20] Con respecto a la duración de la dosificación, para los oligodendrogliomas la duración prescrita por los oncólogos varía considerablemente desde 6 ciclos hasta más de 32 ciclos (es decir, más de tres años). En un estudio, los investigadores compararon a pacientes que recibieron temozolomida durante al menos 12 meses en el ciclo de 5/28 días, dividiendo a dichos pacientes en dos grupos: pacientes de "corto plazo" que recibieron temozolomida durante 12-18 ciclos y aquellos pacientes de "largo plazo" que recibieron 19 o más ciclos (el rango fue de 19 a 32 ciclos). Los investigadores descubrieron que había una ventaja estadísticamente significativa para el tratamiento "a largo plazo" (la supervivencia libre de progresión media para los pacientes "a corto plazo" fue de 95 semanas (seguimiento de 73 semanas), pero para los pacientes "a largo plazo" la supervivencia libre de progresión media aún no se había alcanzado (seguimiento de 134 semanas)). [21] [22]
Debido a su naturaleza difusa e infiltrante, los oligodendrogliomas no se pueden resecar por completo y no son curables mediante escisión quirúrgica . Si la masa tumoral comprime las estructuras cerebrales adyacentes, los neurocirujanos suelen extirpar la mayor parte posible del tumor sin dañar otras estructuras cerebrales sanas y críticas. La cirugía puede ir seguida de quimioterapia , radioterapia o una combinación de ambas; sin embargo, estudios recientes sugieren que la radioterapia no mejora la supervivencia general (incluso cuando se tienen en cuenta la edad, los datos clínicos, la clasificación histológica y el tipo de cirugía). [19] [23] [24]
Los oligodendrogliomas, al igual que todos los demás gliomas infiltrantes , tienen una tasa de recurrencia muy alta (casi uniforme) y su grado aumenta gradualmente con el tiempo. Los tumores recurrentes generalmente se tratan con quimioterapia y radioterapia más agresivas. Recientemente, la cirugía estereotáctica ha demostrado ser exitosa en el tratamiento de tumores pequeños que se han diagnosticado en forma temprana.
Se ha informado de una supervivencia a largo plazo en una minoría de pacientes. [25] Con un tratamiento agresivo y una vigilancia estrecha, es posible superar la expectativa de vida típica de los oligodendrogliomas de bajo grado. El estudio de Westergaard (1997) mostró que los pacientes menores de 20 años tenían una supervivencia media de 17,5 años. Para los pacientes mayores de 30 años, la tasa de supervivencia es menor, pero a medida que aumentan las opciones de tratamiento, la tasa de supervivencia es mayor. Sin embargo, un paciente con mala salud general tiene más probabilidades de morir antes que aquellos que tienen buena salud general. [26] Otro estudio muestra una tasa de supervivencia del 34% después de 20 años. [27] Sin embargo, como se ha comentado anteriormente, estas cifras pueden ser engañosas, ya que no tienen en cuenta los tipos de tratamiento ni la firma genética de los tumores. Además, estos datos históricos pierden importancia debido a la supervivencia relativamente larga de los pacientes (en comparación con otros tipos de tumores cerebrales) y la introducción de nuevas opciones de tratamiento a lo largo del tiempo.