
Un Morfolino , también conocido como oligómero de Morfolino y como oligómero de Morfolino fosforodiamidato ( PMO ), es un tipo de molécula de oligómero (coloquialmente, un oligo ) utilizado en biología molecular para modificar la expresión génica . Su estructura molecular contiene bases de ADN unidas a una columna vertebral de anillos de metilenmorfolina unidos a través de grupos fosforodiamidato . Los morfolinos bloquean el acceso de otras moléculas a secuencias específicas pequeñas (~25 bases) de las superficies de apareamiento de bases del ácido ribonucleico (ARN). Los morfolinos se utilizan como herramientas de investigación para la genética inversa al derribar la función genética.
Este artículo analiza únicamente los oligómeros antisentido de Morfolino, que son análogos de ácidos nucleicos . La palabra "morfolino" puede aparecer en otros nombres químicos, refiriéndose a sustancias químicas que contienen un anillo de morfolina de seis miembros . Para ayudar a evitar confusiones con otras moléculas que contienen morfolina, al describir oligos, "Morfolino" a menudo se escribe con mayúscula como nombre comercial , pero este uso no es consistente en la literatura científica. Los oligomeros de morfolino a veces se denominan PMO (para oligómero de morfolino fosforodiamidato), especialmente en la literatura médica. Vivo-Morfolinos y PPMO son formas modificadas de Morfolinos con grupos químicos unidos covalentemente para facilitar la entrada a las células.
La eliminación de genes se logra reduciendo la expresión de un gen particular en una célula. En el caso de genes que codifican proteínas, esto suele conducir a una reducción de la cantidad de la proteína correspondiente en la célula. Derribar la expresión genética es un método para aprender sobre la función de una proteína en particular; de manera similar, hacer que un exón específico se corte y corte del transcrito de ARN que codifica una proteína puede ayudar a determinar la función del resto proteico codificado por ese exón o, en ocasiones, puede anular la actividad de la proteína por completo. Estas moléculas se han aplicado a estudios en varios organismos modelo , incluidos ratones , peces cebra , ranas y erizos de mar . [1] Los morfolinos también pueden modificar el empalme del pre-ARNm [2] o inhibir la maduración y actividad del miARN. [3] Las técnicas para dirigir Morfolinos a los ARN y administrar Morfolinos a las células se han revisado recientemente en un artículo de revista [4] y en forma de libro. [5]
Los morfolinos se están desarrollando como terapias farmacéuticas dirigidas contra organismos patógenos como bacterias [6] o virus [7] y enfermedades genéticas . [8] Un fármaco a base de morfolino, eteplirsen, de Sarepta Therapeutics recibió la aprobación acelerada de la Administración de Alimentos y Medicamentos de EE. UU . en septiembre de 2016 para el tratamiento de algunas mutaciones que causan la distrofia muscular de Duchenne , [9] aunque el proceso de aprobación estuvo sumido en controversia. La FDA aprobó otros medicamentos a base de morfolino , golodirsen , viltolarsen y casimersen (también para la distrofia muscular de Duchenne) en 2019-2021. [10] [11] [12]
Los morfolino oligos fueron concebidos por Summerton ( Gene Tools ) en AntiVirals Inc. (ahora Sarepta Therapeutics) y desarrollados originalmente en colaboración con Weller. [13]
Los morfolinos son moléculas sintéticas que son producto de un rediseño de la estructura de los ácidos nucleicos naturales . [14] Por lo general, tienen 25 bases de longitud y se unen a secuencias complementarias de ARN o ADN monocatenario mediante emparejamiento de bases de ácido nucleico estándar . En términos de estructura, la diferencia entre los morfolinos y el ADN es que, mientras que los morfolinos tienen bases de ácido nucleico estándar, esas bases están unidas a anillos de metilenmorfolina unidos a través de grupos fosforodiamidato en lugar de fosfatos . [14] La figura compara las estructuras de las dos hebras allí representadas, una de ARN y la otra de un Morfolino. La sustitución de los fosfatos aniónicos por grupos fosforodiamidato sin carga elimina la ionización en el rango de pH fisiológico habitual , por lo que los morfolinos en organismos o células son moléculas sin carga. Toda la columna vertebral de un Morfolino está hecha de estas subunidades modificadas.
Los morfolinos no desencadenan la degradación de sus moléculas de ARN diana, a diferencia de muchos tipos estructurales antisentido (p. ej., fosforotioatos , ARNip ). En cambio, los morfolinos actúan mediante "bloqueo estérico", uniéndose a una secuencia objetivo dentro de un ARN, inhibiendo moléculas que de otro modo podrían interactuar con el ARN. [15] Los oligos morfolino se utilizan a menudo para investigar el papel de una transcripción de ARNm específica en un embrión . Los biólogos del desarrollo inyectan oligos de Morpholino en huevos o embriones de pez cebra , [16] rana africana con garras ( Xenopus ), [17] erizo de mar [18] y killis ( F. heteroclitus ) produciendo embriones morfantes , o electroporan Morpholinos en embriones de polluelo [19]. en etapas posteriores de desarrollo. Con sistemas de administración citosólicos adecuados, los morfolinos son eficaces en cultivos celulares . [20] [21] Vivo-Morfolinos, en el que el oligo está unido covalentemente a un dendrímero de administración , ingresa a las células cuando se administra sistémicamente en animales adultos o en cultivos de tejidos. [22]
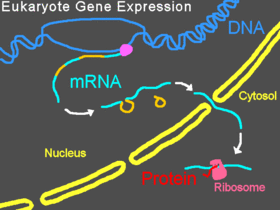
En los organismos eucariotas , el pre-ARNm se transcribe en el núcleo, los intrones se eliminan y luego el ARNm maduro se exporta desde el núcleo al citoplasma . La pequeña subunidad del ribosoma generalmente comienza uniéndose en el extremo 5' del ARNm y allí se une a varios otros factores de iniciación eucariotas , formando el complejo de iniciación. El complejo de iniciación explora a lo largo de la cadena de ARNm hasta que alcanza un codón de inicio , y luego la subunidad grande del ribosoma se une a la subunidad pequeña y comienza la traducción de una proteína . Todo este proceso se conoce como expresión genética; es el proceso por el cual la información de un gen , codificada como una secuencia de bases en el ADN , se convierte en la estructura de una proteína. Un Morfolino puede modificar el empalme, bloquear la traducción o bloquear otros sitios funcionales en el ARN dependiendo de la secuencia de bases del Morfolino.

Unidos a la región 5' no traducida del ARN mensajero (ARNm), los morfolinos pueden interferir con la progresión del complejo de iniciación ribosomal desde la tapa 5' hasta el codón de inicio. Esto evita la traducción de la región codificante del transcrito objetivo (lo que se denomina expresión genética " derribadora " ). Esto es útil experimentalmente cuando un investigador desea conocer la función de una proteína en particular; Los morfolinos proporcionan un medio conveniente para reducir la expresión de la proteína y aprender cómo esa eliminación cambia las células o el organismo. Algunos morfolinos inhiben la expresión con tanta eficacia que, después de la degradación de las proteínas preexistentes, las proteínas objetivo se vuelven indetectables mediante Western blot .
En 2016, se descubrió que una PMO sintética conjugada con péptidos (PPMO) inhibe la expresión de la metalo-beta-lactamasa de Nueva Delhi , una enzima que muchas bacterias resistentes a los medicamentos utilizan para destruir los carbapenémicos. [23] [24]

Los morfolinos pueden interferir con los pasos de procesamiento del pre-ARNm, ya sea evitando que los pequeños complejos de ribonucleoproteínas nucleares ( snRNP ) que dirigen el empalme se unan a sus objetivos en los bordes de los intrones en una hebra de pre-ARNm, o bloqueando la base de adenina nucleofílica y previniéndola. de la formación de la estructura del lazo de empalme, o interfiriendo con la unión de proteínas reguladoras de empalme, como los silenciadores de empalme [25] y los potenciadores de empalme . [26] Prevenir la unión de snRNP U1 (en el sitio donante) o U2 / U5 (en el resto de polipirimidina y el sitio aceptor) puede provocar un empalme modificado , que comúnmente excluye exones del ARNm maduro. Dirigirse a algunos objetivos de empalme da como resultado inclusiones de intrones, mientras que la activación de sitios de empalme crípticos puede conducir a inclusiones o exclusiones parciales. [27] Los objetivos de snRNP U11 / U12 también se pueden bloquear. [28] La modificación del empalme se puede analizar convenientemente mediante la reacción en cadena de la polimerasa con transcriptasa inversa ( RT-PCR ) y se observa como un cambio de banda después de la electroforesis en gel de los productos de RT-PCR. [2]
Los morfolinos se han utilizado para bloquear la actividad de miARN [29] [30] y la maduración. [3] Los morfolinos marcados con fluoresceína combinados con anticuerpos específicos de fluoresceína se pueden utilizar como sondas para la hibridación in situ con miARN. [31] Los morfolinos pueden bloquear la actividad de las ribozimas . [32] Las funciones snRNP U2 y U12 han sido inhibidas por Morfolinos. [33] Los morfolinos dirigidos a secuencias de ARNm "resbaladizas" dentro de regiones codificantes de proteínas pueden inducir cambios de marco de traducción . [34] Los morfolinos pueden bloquear la edición de ARN, [35] las colas poli-A [36] y las secuencias de translocación. [37] Las actividades de Morfolino contra esta variedad de objetivos sugieren que Morfolinos puede usarse como una herramienta de propósito general para bloquear interacciones de proteínas o ácidos nucleicos con ARNm.
Los morfolinos se han convertido en una herramienta de eliminación estándar en los sistemas embrionarios de animales , que tienen una gama más amplia de expresión genética que las células adultas y pueden verse fuertemente afectados por una interacción fuera del objetivo. Después de las inyecciones iniciales en embriones de rana o pez en las etapas unicelular o de pocas células, los efectos del Morfolino se pueden medir hasta cinco días después, [38] después de que hayan pasado la mayoría de los procesos de organogénesis y diferenciación , observándose fenotipos consistentes con eliminación del gen diana. Los oligos de control con secuencias irrelevantes generalmente no producen cambios en el fenotipo embrionario, evidencia de la especificidad de secuencia del oligo Morfolino y falta de efectos no antisentido. La dosis requerida para una caída se puede reducir mediante la coinyección de varios oligos de Morfolino dirigidos al mismo ARNm, lo cual es una estrategia eficaz para reducir o eliminar las interacciones de ARN fuera del objetivo dependientes de la dosis. [39]
Los experimentos de rescate de ARNm a veces pueden restaurar el fenotipo de tipo salvaje en los embriones y proporcionar evidencia de la especificidad de un Morfolino. En un rescate de ARNm, se inyecta conjuntamente a un Morfolino un ARNm que codifica la proteína del Morfolino. Sin embargo, el ARNm de rescate tiene una 5'-UTR (región no traducida) modificada de modo que el ARNm de rescate no contiene ninguna diana para el Morfolino. La región codificante del ARNm de rescate codifica la proteína de interés. La traducción del ARNm de rescate reemplaza la producción de la proteína que fue derribada por el Morfolino. Dado que el ARNm de rescate no afectaría los cambios fenotípicos debido a la modulación de la expresión genética fuera del objetivo de Morfolino, este retorno al fenotipo de tipo salvaje es una prueba más de la especificidad de Morfolino. [38] En algunos casos, la expresión ectópica del ARN de rescate hace imposible la recuperación del fenotipo de tipo salvaje.
En embriones, los Morfolinos pueden probarse en mutantes nulos para comprobar si hay interacciones inesperadas de ARN y luego usarse en un embrión de tipo salvaje para revelar el fenotipo de caída aguda. El fenotipo de caída es a menudo más extremo que el fenotipo mutante; en el mutante, los efectos de la pérdida del gen nulo pueden ocultarse mediante compensación genética. [40]
Debido a su columna vertebral completamente antinatural, los morfolinos no son reconocidos por las proteínas celulares. Las nucleasas no degradan los morfolinos, [41] ni se degradan en el suero ni en las células. [42]
Hasta el 18% de los morfolinos parecen inducir fenotipos no relacionados con el objetivo, incluida la muerte celular en el sistema nervioso central y los tejidos somitas de los embriones de pez cebra. [43] La mayoría de estos efectos se deben a la activación de la apoptosis mediada por p53 y pueden suprimirse mediante la coinyección de un Morfolino anti-p53 junto con el Morfolino experimental. Además, el efecto apoptótico mediado por p53 de una caída de Morfolino se ha fenocopiado utilizando otro tipo estructural antisentido, lo que muestra que la apoptosis mediada por p53 es una consecuencia de la pérdida de la proteína objetivo y no una consecuencia del tipo oligo de caída. [44] Parece que estos efectos son específicos de la secuencia; Como en la mayoría de los casos, si un Morfolino está asociado con efectos no objetivo, el desajuste de 4 bases de Morfolino no desencadenará estos efectos.
Un motivo de preocupación en el uso de Morpholinos es la posibilidad de que se produzcan efectos "fuera del objetivo". Si un fenotipo morfante observado se debe a la eliminación prevista o a una interacción con un ARN fuera del objetivo a menudo se puede abordar en embriones ejecutando otro experimento para confirmar que el fenotipo morfante observado resulta de la eliminación del objetivo esperado. Esto se puede hacer recapitulando el fenotipo morfante con un segundo Morfolino no superpuesto dirigido al mismo ARNm, [38] mediante la confirmación de los fenotipos observados comparándolos con una cepa mutante (aunque la compensación oscurecerá un fenotipo en algunos mutantes), mediante probar el Morfolino en un entorno mutante nulo para detectar cambios fenotípicos adicionales o mediante métodos dominantes negativos. Como se mencionó anteriormente, el rescate de los fenotipos observados mediante la coinyección de un ARNm de rescate es, cuando sea posible, una prueba confiable de la especificidad de un Morfolino. [38] [40]
Para que un Morfolino sea efectivo, debe pasar la membrana celular hacia el citosol de una célula. Una vez en el citosol, los morfolinos se difunden libremente entre el citosol y el núcleo, como lo demuestra la actividad modificadora del empalme nuclear de los morfolinos observada después de la microinyección en el citosol de las células. Se utilizan diferentes métodos para la administración a embriones, a células cultivadas o a animales adultos. Por lo general, se utiliza un aparato de microinyección para la administración en un embrión, y las inyecciones se realizan más comúnmente en la etapa de una sola célula o de pocas células; [45] un método alternativo para la entrega embrionaria es la electroporación , que puede entregar oligos en tejidos de etapas embrionarias posteriores. [46] Las técnicas comunes para la administración en células cultivadas incluyen el péptido Endo-Porter (que hace que el Morfolino se libere de los endosomas ), [21] el sistema de administración especial (que ya no está disponible comercialmente, usaba un heterodúplex de Morfolino-ADN y un etoxilado). reactivo de administración de polietilenimina ), [20] electroporación, [47] o carga por raspado. [48]
La administración a tejidos adultos suele ser difícil, aunque existen algunos sistemas que permiten la captación útil de oligos de morfolino no modificados (incluida la captación en células musculares con distrofia muscular de Duchenne [49] o las células endoteliales vasculares estresadas durante la angioplastia con balón [50] ). Aunque penetran eficazmente a través de los espacios intercelulares de los tejidos, las PMO no conjugadas tienen una distribución limitada en el citosol y los espacios nucleares dentro de los tejidos sanos después de la administración intravenosa. La administración sistémica a muchas células en organismos adultos se puede lograr mediante el uso de conjugados covalentes de oligos de Morfolino con péptidos que penetran en las células y, aunque la toxicidad se ha asociado con dosis moderadas de los conjugados peptídicos, [51] [52] se han utilizado en vivo para la administración eficaz de oligonucleótidos en dosis inferiores a las que causan la toxicidad observada. [7] [53] Un dendrímero de octa-guanidinio unido al extremo de un Morfolino puede entregar el oligo modificado (llamado Vivo-Morfolino) de la sangre al citosol. [22] [54] Los morfolinos de administración, como los conjugados de péptidos y Vivo-Morfolinos, se muestran prometedores como terapias para enfermedades virales y genéticas. [55]
{{cite book}}: |journal=ignorado ( ayuda )