El nucléolo ( / nj uː ˈ k l i ˈ ə l ə s , ˌ nj uː k l i ˈ oʊ l ə s / ; pl .: nucléolos / - l aɪ / ) es la estructura más grande del núcleo de las células eucariotas . [1] Es mejor conocido como el sitio de la biogénesis de los ribosomas . El nucléolo también participa en la formación de partículas de reconocimiento de señales y desempeña un papel en la respuesta de la célula al estrés. [2] Los nucléolos están hechos de proteínas , ADN y ARN , y se forman alrededor de regiones cromosómicas específicas llamadas regiones organizadoras nucleolares . El mal funcionamiento del aparato de Golgi significa que el nucleósido es la causa de varias afecciones humanas llamadas "nucleolopatías" [3] [4] y el nucléolo se está investigando como un objetivo para la quimioterapia contra el cáncer . [5] [6]
El nucléolo fue identificado mediante microscopía de campo claro durante la década de 1830. [7] Theodor Schwann, en su tratado de 1939, describe que Schleiden había identificado pequeños corpúsculos en los núcleos y nombra la estructura "Kernkörperchen". En una traducción de la obra al inglés de 1947, la estructura recibe el nombre de "nucleolo". [8] [9]
Además de estas peculiaridades del citoblasto, ya conocidas por Brown y Meyen, Schleiden ha descubierto en su interior un pequeño corpúsculo (véase lámina I, fig. 1, 4) que, en el citoblasto completamente desarrollado, parece un anillo grueso o un glóbulo hueco de paredes gruesas. Sin embargo, parece presentar un aspecto diferente en diferentes citoblastos. A veces sólo se puede distinguir el círculo externo claramente definido de este anillo, con un punto oscuro en el centro; a veces, y de hecho lo más frecuente, sólo una mancha claramente delimitada. En otros casos, esta mancha es muy pequeña y a veces no se puede reconocer en absoluto. Como será necesario hablar con frecuencia de este cuerpo en el siguiente tratado, por razones de brevedad lo llamaré "nucleolo" (Kernkorperchen, "corpúsculo-núcleo").
— Theodor Schwann, traducido por Henry Smith, Investigaciones microscópicas sobre la concordancia en la estructura y el crecimiento de animales y plantas, página 3
Poco se sabía sobre la función del nucléolo hasta 1964, cuando un estudio [10] de los nucléolos por John Gurdon y Donald Brown en la rana africana con garras Xenopus laevis generó un creciente interés en la función y la estructura detallada del nucléolo. Encontraron que el 25% de los huevos de rana no tenían nucléolo, y que dichos huevos no eran capaces de vivir. La mitad de los huevos tenían un nucléolo y el 25% tenían dos. Concluyeron que el nucléolo tenía una función necesaria para la vida. En 1966, Max L. Birnstiel y colaboradores demostraron mediante experimentos de hibridación de ácidos nucleicos que el ADN dentro de los nucléolos codifica el ARN ribosómico . [11] [12]
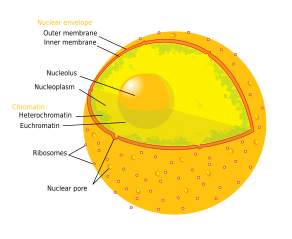
Se reconocen tres componentes principales del nucléolo: el centro fibrilar (CF), el componente fibrilar denso (CFD) y el componente granular (CG). [1] La transcripción del ADNr ocurre en el CF. [13] El CFD contiene la proteína fibrilarina , [13] que es importante en el procesamiento del ARNr. El CG contiene la proteína nucleofosmina , [13] (B23 en la imagen externa), que también está involucrada en la biogénesis de los ribosomas .
Sin embargo, se ha propuesto que esta organización particular solo se observa en eucariotas superiores y que evolucionó a partir de una organización bipartita con la transición de anamniotas a amniotas . Como reflejo del aumento sustancial de la región intergénica del ADN , un componente fibrilar original se habría separado en el FC y el DFC. [14]
Otra estructura identificada dentro de muchos nucléolos (particularmente en plantas) es un área clara en el centro de la estructura denominada vacuola nucleolar. [15] Se ha demostrado que los nucléolos de varias especies de plantas tienen concentraciones muy altas de hierro [16] en contraste con los nucléolos de células humanas y animales.
La ultraestructura del nucléolo se puede observar a través de un microscopio electrónico , mientras que la organización y la dinámica se pueden estudiar a través del marcado de proteínas fluorescentes y la recuperación fluorescente después del fotoblanqueo ( FRAP ). Los anticuerpos contra la proteína PAF49 también se pueden utilizar como marcador del nucléolo en experimentos de inmunofluorescencia. [17]
Aunque normalmente sólo se pueden ver uno o dos nucléolos, una célula humana diploide tiene diez regiones organizadoras de nucléolos (NOR) y podría tener más nucléolos. Lo más frecuente es que en cada nucléolo participen varias NOR. [18]

En la biogénesis de los ribosomas se requieren dos de las tres ARN polimerasas eucariotas ( Pol I y Pol III ), y estas funcionan de manera coordinada. En una etapa inicial, los genes del ARNr son transcritos como una sola unidad dentro del nucléolo por la ARN polimerasa I. Para que se produzca esta transcripción se requieren varios factores asociados a la pol I y factores trans-actuantes específicos del ADN. En la levadura , los más importantes son: UAF ( upstream activating factor ), TBP (TATA-box binding protein) y core binding factor (CBF), que se unen a elementos promotores y forman el complejo de preiniciación (PIC), que a su vez es reconocido por la ARN polimerasa. En los humanos, un PIC similar se ensambla con SL1 , el factor de selectividad del promotor (compuesto por TBP y factores asociados a TBP , o TAF), factores de iniciación de la transcripción y UBF (upstream binding factor). La ARN polimerasa I transcribe la mayoría de las transcripciones de ARNr ( 28S , 18S y 5.8S ), pero la subunidad 5S del ARNr (componente de la subunidad ribosómica 60S) es transcrita por la ARN polimerasa III. [19]
La transcripción del ARNr produce una molécula precursora larga ( pre-ARNr 45S ), que todavía contiene el espaciador transcrito interno (ITS) y el espaciador transcrito externo (ETS). Se necesita un procesamiento adicional para generar las moléculas de ARN 18S, 5.8S y 28S. En eucariotas, las enzimas modificadoras de ARN son llevadas a sus respectivos sitios de reconocimiento por interacción con ARN guía, que se unen a estas secuencias específicas. Estos ARN guía pertenecen a la clase de ARN nucleolares pequeños ( snoRNAs ), que están complejados con proteínas y existen como ribonucleoproteínas nucleolares pequeñas ( snoRNPs ). Una vez que se procesan las subunidades de ARNr, están listas para ser ensambladas en subunidades ribosómicas más grandes. Sin embargo, también es necesaria una molécula de ARNr adicional, el ARNr 5S. En la levadura, la secuencia de ADNr 5S se localiza en el espaciador intergénico y se transcribe en el nucléolo por la ARN polimerasa.
En eucariotas superiores y plantas, la situación es más compleja, ya que la secuencia de ADN 5S se encuentra fuera del NOR y es transcrita por la ARN Pol III en el nucleoplasma , después de lo cual encuentra su camino hacia el nucléolo para participar en el ensamblaje del ribosoma. Este ensamblaje no solo involucra al ARNr, sino también a las proteínas ribosomales . Los genes que codifican estas proteínas r son transcritos por la Pol II en el nucleoplasma mediante una vía "convencional" de síntesis de proteínas (transcripción, procesamiento del pre-ARNm, exportación nuclear del ARNm maduro y traducción en los ribosomas citoplasmáticos). Las proteínas r maduras luego se importan al núcleo y, finalmente, al nucléolo. La asociación y maduración del ARNr y las proteínas r dan como resultado la formación de las subunidades 40S (pequeñas) y 60S (grandes) del ribosoma completo. Estas son exportadas a través de los complejos de poros nucleares al citoplasma, donde permanecen libres o se asocian con el retículo endoplasmático , formando el retículo endoplasmático rugoso (RER). [20] [21]
En las células endometriales humanas se forma a veces una red de canales nucleolares. El origen y la función de esta red aún no se han identificado con claridad. [22]
Además de su papel en la biogénesis ribosómica, se sabe que el nucléolo captura e inmoviliza proteínas, un proceso conocido como detención nucleolar. Las proteínas que están detenidas en el nucléolo no pueden difundirse ni interactuar con sus parejas de unión. Los objetivos de este mecanismo regulador postraduccional incluyen VHL , PML , MDM2 , POLD1 , RelA , HAND1 y hTERT , entre muchos otros. Ahora se sabe que los ARN largos no codificantes que se originan en las regiones intergénicas del nucléolo son responsables de este fenómeno. [23]