Un ciclo Otto es un ciclo termodinámico idealizado que describe el funcionamiento de un motor de pistón de encendido por chispa típico . Es el ciclo termodinámico que se encuentra más comúnmente en los motores de automóviles. [1]
El ciclo de Otto es una descripción de lo que le sucede a un gas cuando se lo somete a cambios de presión, temperatura, volumen, adición y eliminación de calor. El gas que está sujeto a esos cambios se llama sistema. El sistema, en este caso, se define como el fluido (gas) dentro del cilindro. Al describir los cambios que tienen lugar dentro del sistema, también describirá, a la inversa, el efecto del sistema sobre el medio ambiente. En el caso del ciclo Otto, el efecto será producir suficiente trabajo neto del sistema como para impulsar un automóvil y sus ocupantes en el medio ambiente.
El ciclo de Otto se construye a partir de:
El proceso isentrópico de compresión o expansión implica que no habrá ineficiencia (pérdida de energía mecánica) y no habrá transferencia de calor dentro o fuera del sistema durante ese proceso. Se supone que el cilindro y el pistón son impermeables al calor durante ese tiempo. El trabajo se realiza en el sistema durante el proceso de compresión isentrópica inferior. El calor fluye hacia el ciclo Otto a través del proceso de presurización izquierdo y parte regresa a través del proceso de despresurización derecho. La suma del trabajo agregado al sistema más el calor agregado menos el calor eliminado produce el trabajo mecánico neto generado por el sistema.
Los procesos se describen en: [2] [ página necesaria ]
El ciclo de Otto consiste en compresión isentrópica, adición de calor a volumen constante, expansión isentrópica y rechazo de calor a volumen constante. En el caso de un ciclo Otto de cuatro tiempos, técnicamente existen dos procesos adicionales: uno para extraer el calor residual y los productos de la combustión a presión constante (isobárico) y otro para la entrada de aire frío rico en oxígeno también a presión constante. ; sin embargo, estos a menudo se omiten en un análisis simplificado. Aunque esos dos procesos son críticos para el funcionamiento de un motor real, donde los detalles de la transferencia de calor y la química de la combustión son relevantes, para el análisis simplificado del ciclo termodinámico, es más conveniente suponer que todo el calor residual es eliminado durante un único cambio de volumen.
El motor de cuatro tiempos fue patentado por primera vez por Alphonse Beau de Rochas en 1861. [3] Antes, aproximadamente entre 1854 y 1857, dos italianos ( Eugenio Barsanti y Felice Matteucci ) inventaron un motor que se rumoreaba que era muy similar, pero la patente se perdió. [ cita necesaria ]
La primera persona que construyó un motor de cuatro tiempos funcional, un motor estacionario que utilizaba una mezcla de carbón, gas y aire como combustible (un motor de gas ), fue el ingeniero alemán Nicolaus Otto . [4] Esta es la razón por la que el principio de cuatro tiempos hoy en día se conoce comúnmente como ciclo Otto y los motores de cuatro tiempos que utilizan bujías a menudo se denominan motores Otto.
El ciclo consta de cuatro partes: una masa que contiene una mezcla de combustible y oxígeno es aspirada hacia el cilindro por el pistón descendente, es comprimida por el pistón ascendente, la masa se enciende mediante una chispa que libera energía en forma de calor, la masa resultante Se permite que el gas se expanda mientras empuja el pistón hacia abajo y, finalmente, la masa se agota cuando el pistón sube por segunda vez. Como el pistón es capaz de moverse a lo largo del cilindro, el volumen del gas cambia con su posición en el cilindro. Los procesos de compresión y expansión inducidos en el gas por el movimiento del pistón se idealizan como reversibles, es decir, no se pierde trabajo útil por turbulencia o fricción y no se transfiere calor hacia o desde el gas durante esos dos procesos. Una vez completada la expansión en el cilindro, se extrae el calor restante y finalmente el gas se expulsa al medio ambiente. Durante el proceso de expansión se produce trabajo mecánico y parte de él se utiliza para comprimir la masa de aire del siguiente ciclo. El trabajo mecánico producido menos el utilizado para el proceso de compresión es el trabajo neto ganado y que puede utilizarse para propulsión o para accionar otras máquinas. Alternativamente, el trabajo neto ganado es la diferencia entre el calor producido y el calor eliminado.

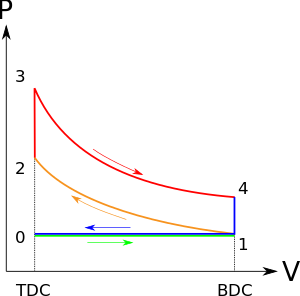
Una masa de aire (fluido de trabajo) ingresa al cilindro, de 0 a 1, a presión atmosférica (presión constante) a través de la válvula de admisión abierta, mientras que la válvula de escape se cierra durante este proceso. La válvula de admisión se cierra en el punto 1.
El pistón se mueve desde el extremo del cigüeñal (PMI, punto muerto inferior y volumen máximo) hasta el extremo de la culata ( PMS , punto muerto superior y volumen mínimo) a medida que el gas de trabajo con el estado inicial 1 se comprime isentrópicamente al punto de estado 2, a través de la relación de compresión ( V 1 / V2 ) . _ Mecánicamente, esta es la compresión isentrópica de la mezcla de aire/combustible en el cilindro, también conocida como carrera de compresión. Este proceso isentrópico supone que no se pierde energía mecánica debido a la fricción y que no se transfiere calor hacia o desde el gas, por lo que el proceso es reversible. El proceso de compresión requiere que se agregue trabajo mecánico al gas de trabajo. Generalmente, la relación de compresión es de alrededor de 9 a 10:1 ( V 1 : V 2 ) para un motor típico. [5]
El pistón está momentáneamente en reposo en el PMS . Durante este instante, que se conoce como fase de encendido, la mezcla aire/combustible permanece en un pequeño volumen en la parte superior de la carrera de compresión. Se añade calor al fluido de trabajo mediante la combustión del combustible inyectado, manteniéndose el volumen esencialmente constante. La presión aumenta y la relación se denomina "relación de explosión".
El aumento de alta presión ejerce una fuerza sobre el pistón y lo empuja hacia el BDC . La expansión del fluido de trabajo se produce de forma isentrópica y el sistema realiza el trabajo sobre el pistón. La relación de volumen se denomina "relación de expansión isentrópica". (Para el ciclo Otto es lo mismo que la relación de compresión ). Mecánicamente, esta es la expansión de la mezcla gaseosa caliente en el cilindro conocida como carrera de expansión (potencia).
El pistón está momentáneamente en reposo en el PMI . La presión del gas de trabajo cae instantáneamente del punto 4 al punto 1 durante un proceso de volumen constante a medida que el calor se elimina a un sumidero externo ideal que se pone en contacto con la culata del cilindro. En los motores de combustión interna modernos, el disipador de calor puede ser aire circundante (para motores de baja potencia) o un fluido en circulación, como un refrigerante. El gas ha vuelto al estado 1.
La válvula de escape se abre en el punto 1. A medida que el pistón se mueve del "BDC" (punto 1) al "TDC" (punto 0) con la válvula de escape abierta, la mezcla gaseosa se ventila a la atmósfera y el proceso comienza de nuevo.
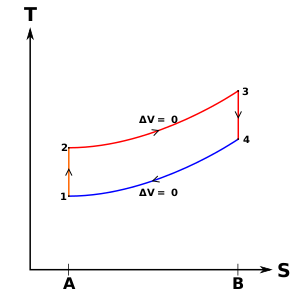
En este proceso 1-2, el pistón trabaja sobre el gas y en el proceso 3-4, el gas trabaja sobre el pistón durante los procesos isentrópicos de compresión y expansión, respectivamente. Los procesos 2–3 y 4–1 son procesos isocóricos; el calor se transfiere al sistema desde 2—3 y fuera del sistema desde 4—1 pero no se realiza trabajo en el sistema ni se extrae del sistema durante esos procesos. No se realiza ningún trabajo durante un proceso isocórico (volumen constante) porque la adición o eliminación de trabajo de un sistema requiere el movimiento de los límites del sistema; por lo tanto, como el volumen del cilindro no cambia, no se agrega ni elimina trabajo del eje del sistema.
Se utilizan cuatro ecuaciones diferentes para describir esos cuatro procesos. Se hace una simplificación suponiendo que los cambios de energía cinética y potencial que tienen lugar en el sistema (masa de gas) pueden despreciarse y luego aplicando la primera ley de la termodinámica (conservación de energía) a la masa de gas a medida que cambia de estado como se caracteriza. por la temperatura, presión y volumen del gas. [2] [ página necesaria ] [6] [ página necesaria ]
Durante un ciclo completo, el gas vuelve a su estado original de temperatura, presión y volumen, por lo que el cambio neto de energía interna del sistema (gas) es cero. Como resultado, la energía (calor o trabajo) agregada al sistema debe compensarse con la energía (calor o trabajo) que sale del sistema. En el análisis de sistemas termodinámicos, la convención es considerar la energía que ingresa al sistema como positiva y la energía que sale del sistema como negativa.
Ecuación 1a.
Durante un ciclo completo, el cambio neto de energía del sistema es cero:
Lo anterior establece que el sistema (la masa de gas) vuelve al estado termodinámico original en el que se encontraba al inicio del ciclo.
¿Dónde se agrega energía al sistema de 1–2–3 y se elimina energía del sistema de 3–4–1? En términos de trabajo y calor añadido al sistema.
Ecuación 1b:
Cada término de la ecuación se puede expresar en términos de la energía interna del gas en cada punto del proceso:
El balance de energía Ecuación 1b se convierte en
Para ilustrar el ejemplo elegimos [ dudoso ] algunos valores para los puntos de la ilustración:
Estos valores se seleccionan arbitraria pero racionalmente [ dudoso ] . Luego se pueden calcular los términos de trabajo y calor.
La energía agregada al sistema como trabajo durante la compresión de 1 a 2 es
La energía agregada al sistema en forma de calor desde el punto 2 al 3 es
La energía eliminada del sistema como trabajo durante la expansión de 3 a 4 es
La energía extraída del sistema en forma de calor del punto 4 al 1 es
El balance energético es
Tenga en cuenta que la energía agregada al sistema se cuenta como positiva y la energía que sale del sistema se cuenta como negativa y la suma es cero como se espera para un ciclo completo que devuelve el sistema a su estado original.
Del balance energético el trabajo realizado por el sistema es:
La energía neta que sale del sistema como trabajo es -1, lo que significa que el sistema ha producido una unidad neta de energía que sale del sistema en forma de trabajo.
El calor neto que sale del sistema es:
La energía agregada al sistema en forma de calor es positiva. De lo anterior parece como si el sistema ganara una unidad de calor. Esto iguala la energía producida por el sistema como trabajo fuera del sistema.
La eficiencia térmica es el cociente entre el trabajo neto del sistema y el calor agregado al sistema. Ecuación 2:
Alternativamente, la eficiencia térmica se puede derivar estrictamente de calor agregado y calor rechazado.
Proporcionando los valores ficticios
En el ciclo de Otto, no hay transferencia de calor durante los procesos 1–2 y 3–4 ya que son procesos isentrópicos. El calor se suministra sólo durante los procesos de volumen constante 2-3 y el calor se rechaza sólo durante los procesos de volumen constante 4-1.
Los valores anteriores son valores absolutos que podrían, por ejemplo [ dudoso ] , tener unidades de julios (suponiendo que se utilice el sistema de unidades MKS) y serían útiles para un motor particular con dimensiones particulares. En el estudio de los sistemas termodinámicos, las cantidades extensivas como la energía, el volumen o la entropía (frente a las cantidades intensivas de temperatura y presión) se colocan sobre la base de una unidad de masa, al igual que los cálculos, lo que los hace más generales y, por lo tanto, más generales. usar. Por lo tanto, cada término que involucra una cantidad extensiva podría dividirse por la masa, dando los términos unidades de julios/kg (energía específica), metros 3 /kg (volumen específico) o julios/(kelvin·kg) (entropía específica, calor). capacidad) etc. y se representaría mediante letras minúsculas, u, v, s, etc.
La ecuación 1 ahora se puede relacionar con la ecuación del calor específico para volumen constante. Los calores específicos son particularmente útiles para cálculos termodinámicos que involucran el modelo de gas ideal .
Reorganización de los rendimientos:
Insertar la ecuación del calor específico en la ecuación de eficiencia térmica (Ecuación 2) produce.
Tras la reorganización:
A continuación, observando los diagramas (ver relaciones isentrópicas para un gas ideal ), ambos pueden omitirse. La ecuación entonces se reduce a:
Ecuación 2:
Dado que el ciclo de Otto utiliza procesos isentrópicos durante la compresión (proceso 1 a 2) y la expansión (proceso 3 a 4), las ecuaciones isentrópicas de los gases ideales y las relaciones constantes de presión/volumen se pueden utilizar para producir las ecuaciones 3 y 4. [7]
Ecuación 3:
Ecuación 4:
Simplificando aún más la Ecuación 4, donde está la relación de compresión :
Ecuación 5:
Al invertir la Ecuación 4 e insertarla en la Ecuación 2, la eficiencia térmica final se puede expresar como: [ página necesaria ] [6] [ página necesaria ]
Ecuación 6:
Al analizar la ecuación 6 es evidente que la eficiencia del ciclo Otto depende directamente de la relación de compresión . Dado que el valor de aire es 1,4, un aumento de producirá un aumento de . Sin embargo, el valor de los productos de combustión de la mezcla de combustible y aire suele ser aproximadamente 1,3. La discusión anterior implica que es más eficiente tener una relación de compresión alta. La relación estándar es aproximadamente 10:1 para los automóviles típicos. Por lo general, esto no aumenta mucho debido a la posibilidad de autoignición o " golpe ", que impone un límite superior a la relación de compresión. [2] [ página necesaria ] Durante el proceso de compresión 1–2 la temperatura aumenta, por lo tanto, un aumento en la relación de compresión provoca un aumento en la temperatura. La autoignición ocurre cuando la temperatura de la mezcla de combustible y aire aumenta demasiado antes de que el frente de llama la encienda. La carrera de compresión tiene como objetivo comprimir los productos antes de que la llama encienda la mezcla. Si se aumenta la relación de compresión, la mezcla puede autoencenderse antes de que se complete la carrera de compresión, lo que provoca "golpes del motor". Esto puede dañar los componentes del motor y disminuirá la potencia de frenado del motor.
La potencia producida por el ciclo Otto es una energía desarrollada por unidad de tiempo. Los motores Otto se denominan motores de cuatro tiempos. La carrera de admisión y la carrera de compresión requieren una rotación del cigüeñal del motor. La carrera de potencia y la carrera de escape requieren otra rotación. Para dos rotaciones hay un trazo que genera trabajo.
Del análisis del ciclo anterior, el trabajo neto producido por el sistema:
(nuevamente, usando la convención de signos, el signo menos implica que la energía sale del sistema en forma de trabajo)
Si las unidades utilizadas fueran MKS, el ciclo habría producido un julio de energía en forma de trabajo. Para un motor de una cilindrada particular, como un litro, la masa de gas del sistema se puede calcular suponiendo que el motor funciona a temperatura estándar (20 °C) y presión (1 atm). Usando la Ley Universal de los Gases, la masa de un litro de gas está a temperatura ambiente y presión al nivel del mar:
A una velocidad del motor de 3000 RPM hay 1500 golpes de trabajo/minuto o 25 golpes de trabajo/segundo.
La potencia es 25 veces mayor ya que hay 25 golpes de trabajo/segundo
Si el motor utiliza varios cilindros con la misma cilindrada, el resultado se multiplicaría por el número de cilindros. Estos resultados son el producto de los valores de la energía interna que se asumieron para los cuatro estados del sistema al final de cada uno de los cuatro tiempos (dos rotaciones). Fueron seleccionados sólo con fines ilustrativos y, evidentemente, son de escaso valor. La sustitución de valores reales de un motor real produciría resultados más cercanos a los del motor. Cuyos resultados serían superiores a los del motor real, ya que en el análisis se hacen muchas suposiciones simplificadoras que pasan por alto las ineficiencias. Tales resultados sobreestimarían la producción de energía.
La diferencia entre las presiones y temperaturas de escape y admisión significa que se puede lograr cierto aumento en la eficiencia mediante el uso de un turbocompresor , eliminando del flujo de escape una parte de la energía restante y transfiriéndola al flujo de admisión para aumentar la presión de admisión. Una turbina de gas puede extraer energía de trabajo útil de la corriente de escape y luego puede usarse para presurizar el aire de admisión. La presión y la temperatura de los gases de escape se reducirían a medida que se expanden a través de la turbina de gas y ese trabajo luego se aplica a la corriente de gas de entrada, aumentando su presión y temperatura. La transferencia de energía supone una mejora de la eficiencia y también mejora la densidad de potencia resultante del motor. El aire de admisión normalmente se enfría para reducir su volumen, ya que el trabajo producido por carrera es una función directa de la cantidad de masa que ingresa al cilindro; un aire más denso producirá más trabajo por ciclo. En la práctica, también es necesario reducir la temperatura de la masa de aire de admisión para evitar un encendido prematuro en un motor de gasolina; por lo tanto, se utiliza un intercooler para eliminar parte de la energía en forma de calor y así reducir la temperatura de entrada. Este esquema aumenta la eficiencia y la potencia del motor.
La aplicación de un sobrealimentador impulsado por el cigüeñal aumenta la potencia de salida (densidad de potencia), pero no aumenta la eficiencia, ya que utiliza parte del trabajo neto producido por el motor para presurizar el aire de admisión y no logra extraer la energía que de otro modo se desperdiciaría asociada con el cigüeñal. flujo de escape a alta temperatura y una presión al ambiente.