
La teoría de la solución de Flory-Huggins es un modelo reticular de la termodinámica de las soluciones de polímeros que tiene en cuenta la gran disimilitud en los tamaños moleculares al adaptar la expresión habitual para la entropía de la mezcla . El resultado es una ecuación para el cambio de energía libre de Gibbs para mezclar un polímero con un disolvente . Aunque hace suposiciones simplificadoras, genera resultados útiles para interpretar experimentos.
La ecuación termodinámica para el cambio de energía de Gibbs que acompaña a la mezcla a temperatura y presión (externa) constantes es
Un cambio, denotado por , es el valor de una variable para una solución o mezcla menos los valores de los componentes puros considerados por separado. El objetivo es encontrar fórmulas explícitas para y , los incrementos de entalpía y entropía asociados con el proceso de mezcla .
El resultado obtenido por Flory [1] y Huggins [2] es
El lado derecho es una función del número de moles y fracción de volumen de solvente ( componente ), el número de moles y fracción de volumen de polímero (componente ), con la introducción de un parámetro para tener en cuenta la energía de las moléculas de polímero y solvente que se dispersan entre sí. es la constante de los gases y es la temperatura absoluta . La fracción de volumen es análoga a la fracción molar , pero se pondera para tener en cuenta los tamaños relativos de las moléculas. Para un soluto pequeño, aparecerían en su lugar las fracciones molares, y esta modificación es la innovación debida a Flory y Huggins. En el caso más general, el parámetro de mezcla, , es un parámetro de energía libre, que incluye un componente entrópico. [1] [2]
Primero calculamos la entropía de mezcla , el aumento en la incertidumbre sobre las ubicaciones de las moléculas cuando están intercaladas. En las fases condensadas puras ( disolvente y polímero), en todas partes que miremos encontramos una molécula. [3] Por supuesto, cualquier noción de "encontrar" una molécula en una ubicación dada es un experimento mental, ya que en realidad no podemos examinar ubicaciones espaciales del tamaño de las moléculas. La expresión para la entropía de mezcla de moléculas pequeñas en términos de fracciones molares ya no es razonable cuando el soluto es una cadena macromolecular . Tomamos en cuenta esta disimetría en los tamaños moleculares al suponer que los segmentos de polímero individuales y las moléculas de disolvente individuales ocupan sitios en una red . Cada sitio está ocupado por exactamente una molécula del disolvente o por un monómero de la cadena de polímero, por lo que el número total de sitios es
donde es el número de moléculas de disolvente y es el número de moléculas de polímero, cada una de las cuales tiene segmentos. [4]
Para un paseo aleatorio en una red [3] podemos calcular el cambio de entropía (el aumento de la incertidumbre espacial ) como resultado de mezclar soluto y solvente.
donde es la constante de Boltzmann . Defina las fracciones de volumen reticular y
Éstas son también las probabilidades de que un sitio reticular dado, elegido al azar , esté ocupado por una molécula de disolvente o un segmento de polímero, respectivamente. Por lo tanto
Para un soluto pequeño cuyas moléculas ocupan sólo un sitio reticular, es decir uno, las fracciones de volumen se reducen a fracciones moleculares o molares , y recuperamos la entropía habitual de la mezcla .
Además del efecto entrópico, podemos esperar un cambio de entalpía . [5] Hay tres interacciones moleculares a considerar: solvente-solvente , monómero-monómero (no el enlace covalente , sino entre diferentes secciones de la cadena) y monómero-solvente . Cada una de las últimas ocurre a expensas del promedio de las otras dos, por lo que el incremento de energía por contacto monómero-solvente es
El número total de dichos contactos es
donde es el número de coordinación, el número de vecinos más cercanos para un sitio de la red, cada uno ocupado por un segmento de cadena o una molécula de solvente. Es decir, es el número total de segmentos de polímero (monómeros) en la solución, por lo que es el número de sitios vecinos más cercanos a todos los segmentos de polímero. Multiplicando por la probabilidad de que cualquiera de esos sitios esté ocupado por una molécula de solvente, [6] obtenemos el número total de interacciones moleculares polímero-solvente. Se realiza una aproximación siguiendo la teoría del campo medio siguiendo este procedimiento, reduciendo así el complejo problema de muchas interacciones a un problema más simple de una interacción.
El cambio de entalpía es igual al cambio de energía por interacción monómero-disolvente de polímero multiplicado por el número de dichas interacciones.
El parámetro de interacción polímero-disolvente chi se define como
Depende de la naturaleza tanto del disolvente como del soluto, y es el único parámetro específico del material en el modelo. El cambio de entalpía se convierte en
Reuniendo términos, el cambio total de energía libre es
donde hemos convertido la expresión de moléculas a moles y transfiriendo la constante de Avogadro a la constante de los gases .
El valor del parámetro de interacción se puede estimar a partir de los parámetros de solubilidad de Hildebrand y
donde es el volumen real de un segmento de polímero.
En el caso más general, la interacción y el parámetro de mezcla resultante, , es un parámetro de energía libre, por lo que incluye un componente entrópico. [1] [2] Esto significa que, además de la entropía de mezcla regular, existe otra contribución entrópica de la interacción entre el disolvente y el monómero. Esta contribución a veces es muy importante para hacer predicciones cuantitativas de las propiedades termodinámicas.
Existen teorías de solución más avanzadas, como la teoría de Flory-Krigbaum.
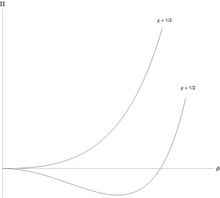
Los polímeros pueden separarse del solvente y lo hacen de una manera característica. [4] La energía libre de Flory-Huggins por unidad de volumen, para un polímero con monómeros, se puede escribir en una forma simple adimensional .
para la fracción de volumen de monómeros, y . La presión osmótica (en unidades reducidas) es
La solución de polímero es estable con respecto a pequeñas fluctuaciones cuando la segunda derivada de esta energía libre es positiva. Esta segunda derivada es
y la solución primero se vuelve inestable cuando esta y la tercera derivada
son ambos iguales a cero. Un poco de álgebra muestra que la solución de polímero primero se vuelve inestable en un punto crítico en
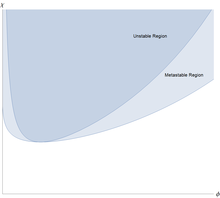
Esto significa que para todos los valores de la interacción monómero-disolvente efectiva es débilmente repulsiva, pero esto es demasiado débil para causar la separación líquido/líquido. Sin embargo, cuando , hay separación en dos fases coexistentes, una más rica en polímero pero más pobre en disolvente que la otra.
La característica inusual de la separación de fases líquido/líquido es que es altamente asimétrica: la fracción de volumen de monómeros en el punto crítico es aproximadamente , lo cual es muy pequeño para polímeros grandes. La cantidad de polímero en la fase coexistente rica en solvente/pobre en polímero es extremadamente pequeña para polímeros largos. La fase rica en solvente está cerca del solvente puro. Esto es peculiar de los polímeros, una mezcla de moléculas pequeñas se puede aproximar utilizando la expresión de Flory-Huggins con , y entonces y ambas fases coexistentes están lejos de ser puras.
Los polímeros sintéticos rara vez consisten en cadenas de longitud uniforme en el disolvente. La densidad de energía libre de Flory-Huggins se puede generalizar [5] a una mezcla de polímeros de N componentes con longitudes de
Para una mezcla de polímeros binarios , donde una especie consta de monómeros y la otra de monómeros, esto se simplifica a
Al igual que en el caso de las soluciones de polímeros diluidos, los dos primeros términos del lado derecho representan la entropía de la mezcla. Para polímeros grandes de y estos términos son despreciablemente pequeños. Esto implica que para que exista una mezcla estable , entonces para que los polímeros A y B se mezclen sus segmentos deben atraerse entre sí. [6]
La teoría de Flory-Huggins tiende a concordar bien con los experimentos en el régimen de concentración semidiluida y se puede utilizar para ajustar los datos para mezclas aún más complicadas con concentraciones más altas. La teoría predice cualitativamente la separación de fases, la tendencia de las especies de alto peso molecular a ser inmiscibles, la dependencia de la temperatura de interacción y otras características observadas comúnmente en mezclas de polímeros. Sin embargo, la teoría de Flory-Huggins sin modificar no predice la temperatura crítica de solución más baja observada en algunas mezclas de polímeros y la falta de dependencia de la temperatura crítica en la longitud de la cadena . [7] Además, se puede demostrar que para una mezcla binaria de especies de polímeros con longitudes de cadena iguales, la concentración crítica debería ser ; sin embargo, se han observado mezclas de polímeros donde este parámetro es altamente asimétrico. En ciertas mezclas, la entropía de mezcla puede dominar sobre la interacción de monómeros. Al adoptar la aproximación de campo medio, se descartó la dependencia compleja de parámetros en la temperatura , la composición de la mezcla y la longitud de la cadena. Específicamente, las interacciones más allá del vecino más cercano pueden ser altamente relevantes para el comportamiento de la mezcla y la distribución de los segmentos de polímero no es necesariamente uniforme, por lo que ciertos sitios de la red pueden experimentar energías de interacción dispares de las aproximadas por la teoría del campo medio.
Un efecto bien estudiado [4] [6] sobre las energías de interacción que la teoría de Flory-Huggins no modificada descuida es la correlación de cadenas. En mezclas de polímeros diluidos, donde las cadenas están bien separadas, las fuerzas intramoleculares entre los monómeros de la cadena de polímero dominan y conducen a la desmezcla, lo que conduce a regiones donde la concentración de polímero es alta. A medida que aumenta la concentración de polímero, las cadenas tienden a superponerse y el efecto se vuelve menos importante. De hecho, la demarcación entre soluciones diluidas y semidiluidas se define comúnmente por la concentración en la que los polímeros comienzan a superponerse, que se puede estimar como
Aquí, m es la masa de una sola cadena de polímero y es el radio de giro de la cadena .