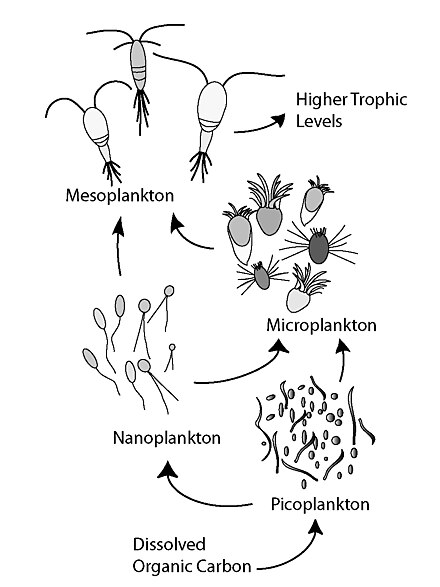
El bucle microbiano describe una vía trófica donde, en los sistemas acuáticos, el carbono orgánico disuelto (COD) se devuelve a niveles tróficos superiores a través de su incorporación a la biomasa bacteriana, y luego se acopla con la cadena alimentaria clásica formada por fitoplancton - zooplancton - necton . En los sistemas del suelo, el bucle microbiano se refiere al carbono del suelo . El término bucle microbiano fue acuñado por Farooq Azam , Tom Fenchel et al. [1] en 1983 para incluir el papel desempeñado por las bacterias en los ciclos de carbono y nutrientes del entorno marino.
En general, el carbono orgánico disuelto (COD) se introduce en el ambiente oceánico a partir de la lisis bacteriana , la fuga o exudación de carbono fijado del fitoplancton (p. ej., exopolímero mucilaginoso de diatomeas ), la senescencia celular repentina , la alimentación descuidada del zooplancton, la excreción de productos de desecho por parte de animales acuáticos o la descomposición o disolución de partículas orgánicas de plantas terrestres y suelos. [2] Las bacterias en el circuito microbiano descomponen este detrito particulado para utilizar esta materia rica en energía para el crecimiento. Dado que más del 95% de la materia orgánica en los ecosistemas marinos consiste en compuestos poliméricos de alto peso molecular (APM) (p. ej., proteínas, polisacáridos, lípidos), solo una pequeña porción de la materia orgánica disuelta total (DOM) es fácilmente utilizable para la mayoría de los organismos marinos en niveles tróficos superiores. Esto significa que el carbono orgánico disuelto no está disponible directamente para la mayoría de los organismos marinos; las bacterias marinas introducen este carbono orgánico en la red alimentaria, lo que da como resultado energía adicional que se vuelve disponible para niveles tróficos superiores. Recientemente, el término " red alimentaria microbiana " ha sido sustituido por el término "bucle microbiano".
Antes del descubrimiento del circuito microbiano, la visión clásica de las redes alimentarias marinas era la de una cadena lineal desde el fitoplancton hasta el necton . En general, no se pensaba que las bacterias marinas fueran consumidores importantes de materia orgánica (incluido el carbono), aunque se sabía que existían. Sin embargo, la visión de una red alimentaria pelágica marina fue cuestionada durante los años 1970 y 1980 por Pomeroy y Azam, quienes sugirieron la vía alternativa del flujo de carbono desde las bacterias a los protozoos y a los metazoos . [3] [1]
Los primeros trabajos en ecología marina que investigaron el papel de las bacterias en los ambientes oceánicos concluyeron que su papel era mínimo. Los métodos tradicionales de recuento de bacterias (por ejemplo, el cultivo en placas de agar ) solo arrojaron pequeñas cantidades de bacterias que eran mucho menores que su abundancia ambiental real en el agua de mar. Los avances en la tecnología para el recuento de bacterias han llevado a comprender la importancia significativa de las bacterias marinas en los ambientes oceánicos.
En la década de 1970, Francisco et al. (1973) y Hobbie et al. (1977) desarrollaron la técnica alternativa del recuento microscópico directo. Las células bacterianas se contaron con un microscopio de epifluorescencia , produciendo lo que se denomina un " recuento directo de naranja de acridina " (AODC). Esto condujo a una reevaluación de la gran concentración de bacterias en el agua de mar, que se encontró que era mayor de lo esperado (normalmente del orden de 1 millón por mililitro). Además, el desarrollo del "ensayo de productividad bacteriana" mostró que una gran fracción (es decir, el 50%) de la producción primaria neta (NPP) era procesada por bacterias marinas.
En 1974, Larry Pomeroy publicó un artículo en BioScience titulado "La red alimentaria del océano: un paradigma cambiante", donde se destacó el papel clave de los microbios en la productividad del océano. [3] A principios de la década de 1980, Azam y un panel de destacados científicos oceánicos publicaron la síntesis de su discusión en la revista Marine Ecology Progress Series titulada "El papel ecológico de los microbios de la columna de agua en el mar". El término "bucle microbiano" se introdujo en este artículo, que señaló que los protistas que consumen bacterias estaban en la misma clase de tamaño que el fitoplancton y probablemente eran un componente importante de la dieta de los crustáceos planctónicos . [1]
La evidencia acumulada desde entonces ha indicado que algunos de estos protistas bacteriófagos (como los ciliados ) en realidad son depredados selectivamente por estos copépodos . En 1986, Prochlorococcus , que se encuentra en gran abundancia en áreas oligotróficas del océano, fue descubierto por Sallie W. Chisholm , Robert J. Olson y otros colaboradores (aunque había varios registros anteriores de cianobacterias muy pequeñas que contenían clorofila b en el océano [4] [5] Prochlorococcus fue descubierto en 1986 [6] ). [7] A partir de este descubrimiento, los investigadores observaron el papel cambiante de las bacterias marinas a lo largo de un gradiente de nutrientes desde áreas eutróficas a oligotróficas en el océano.
La eficiencia del bucle microbiano está determinada por la densidad de bacterias marinas dentro de él. [8] Ha quedado claro que la densidad bacteriana está controlada principalmente por la actividad de pastoreo de pequeños protozoos y varios grupos taxonómicos de flagelados. Además, la infección viral causa lisis bacteriana, que libera el contenido celular de nuevo al depósito de materia orgánica disuelta (DOM), lo que reduce la eficiencia general del bucle microbiano. La mortalidad por infección viral tiene casi la misma magnitud que la del pastoreo de protozoos. Sin embargo, en comparación con el pastoreo de protozoos, el efecto de la lisis viral puede ser muy diferente porque la lisis es altamente específica del huésped para cada bacteria marina. Tanto el pastoreo de protozoos como la infección viral equilibran la fracción principal del crecimiento bacteriano. Además, el bucle microbiano domina en aguas oligotróficas, en lugar de en áreas eutróficas: allí predomina la cadena alimentaria clásica del plancton, debido al frecuente suministro fresco de nutrientes minerales (por ejemplo, floración primaveral en aguas templadas, áreas de surgencia ). La magnitud de la eficiencia del bucle microbiano se puede determinar midiendo la incorporación bacteriana de sustratos radiomarcados (como timidina tritiada o leucina).
El bucle microbiano es de particular importancia para aumentar la eficiencia de la red alimentaria marina a través de la utilización de materia orgánica disuelta (DOM), que normalmente no está disponible para la mayoría de los organismos marinos. En este sentido, el proceso ayuda al reciclaje de materia orgánica y nutrientes y media la transferencia de energía por encima de la termoclina . Más del 30% del carbono orgánico disuelto (DOC) incorporado a las bacterias se respira y se libera como dióxido de carbono . El otro efecto principal del bucle microbiano en la columna de agua es que acelera la mineralización a través de la producción regenerativa en entornos limitados en nutrientes (por ejemplo, aguas oligotróficas). En general, todo el bucle microbiano es, en cierta medida, típicamente de cinco a diez veces la masa de todos los organismos marinos multicelulares en el ecosistema marino. Las bacterias marinas son la base de la red alimentaria en la mayoría de los entornos oceánicos y mejoran la eficiencia trófica tanto de las redes alimentarias marinas como de los procesos acuáticos importantes (como la productividad de las pesquerías y la cantidad de carbono exportado al fondo del océano). Por lo tanto, el bucle microbiano, junto con la producción primaria, controla la productividad de los sistemas marinos en el océano.
Muchas bacterias planctónicas son móviles y utilizan un flagelo para propagarse y la quimiotaxis para localizar, desplazarse y adherirse a una fuente puntual de materia orgánica disuelta (MOD), donde células de rápido crecimiento digieren la totalidad o parte de la partícula. La acumulación en tan solo unos minutos en esas áreas es directamente observable. Por lo tanto, la columna de agua puede considerarse hasta cierto punto como un lugar organizado espacialmente a pequeña escala, en lugar de un sistema completamente mixto. Esta formación de áreas afecta la transferencia de materia y energía mediada biológicamente en el circuito microbiano.
En la actualidad, se considera que el ciclo microbiano está más extendido. [9] Los compuestos químicos de las bacterias típicas (como el ADN, los lípidos, los azúcares, etc.) y valores similares de relaciones C:N por partícula se encuentran en las micropartículas formadas abióticamente. Las micropartículas son una fuente de alimento potencialmente atractiva para el plancton bacterívoro. Si este es el caso, el ciclo microbiano puede extenderse mediante la vía de transferencia directa de materia orgánica disuelta (DOM) a través de la formación de micropartículas abióticas a niveles tróficos superiores. Esto tiene importancia ecológica de dos maneras. En primer lugar, ocurre sin pérdida de carbono y hace que la materia orgánica esté disponible de manera más eficiente para los organismos fagotróficos, en lugar de solo para las bacterias heterótrofas. Además, la transformación abiótica en el ciclo microbiano extendido depende solo de la temperatura y de la capacidad de la DOM para agregarse, mientras que la transformación biótica depende de su disponibilidad biológica. [9]

Los ecosistemas del suelo son sumamente complejos y están sujetos a diferentes perturbaciones a escala del paisaje que determinan si el carbono del suelo se retiene o se libera a la atmósfera. [11] El destino final del carbono orgánico del suelo es una función de las actividades combinadas de las plantas y los organismos subterráneos, incluidos los microbios del suelo. Aunque se sabe que los microorganismos del suelo sustentan una plétora de funciones biogeoquímicas relacionadas con el ciclo del carbono, [12] la gran mayoría del microbioma del suelo permanece sin cultivar y tiene funciones en gran medida crípticas. [13] Hasta la fecha, solo se ha catalogado una mera fracción de la vida microbiana del suelo, aunque cada vez se descubren más microbios del suelo [13] y virus. [14] Esta falta de conocimiento genera incertidumbre sobre la contribución de los microorganismos del suelo al ciclo del carbono orgánico del suelo y dificulta la construcción de modelos predictivos precisos para el flujo global de carbono en el marco del cambio climático. [15] [10]
La falta de información sobre el potencial metabólico del microbioma del suelo hace que sea particularmente difícil explicar con precisión los cambios en las actividades microbianas que ocurren en respuesta al cambio ambiental. Por ejemplo, los aportes de carbono derivados de las plantas pueden estimular la actividad microbiana para descomponer el carbono orgánico del suelo existente a tasas superiores a las esperadas por los modelos, lo que genera un error en los modelos predictivos de los flujos de carbono. [16] [10]
Para explicar esto, se ha desarrollado un modelo conceptual conocido como la bomba de carbono microbiana, ilustrada en el diagrama de la derecha, para definir cómo los microorganismos del suelo transforman y estabilizan la materia orgánica del suelo. [17] Como se muestra en el diagrama, el dióxido de carbono en la atmósfera es fijado por las plantas (o microorganismos autótrofos) y añadido al suelo a través de procesos como (1) la exudación de las raíces de compuestos de carbono simples de bajo peso molecular, o la deposición de hojarasca y raíz que conduce a la acumulación de polisacáridos vegetales complejos. (2) A través de estos procesos, el carbono se vuelve biodisponible para la "fábrica" metabólica microbiana y posteriormente es (3) respirado a la atmósfera o (4) entra en el depósito de carbono estable como necromasa microbiana. El equilibrio exacto del eflujo de carbono frente a la persistencia es una función de varios factores, incluyendo la composición de la comunidad de plantas sobre el suelo y los perfiles de exudado de las raíces, las variables ambientales y los fenotipos microbianos colectivos (es decir, el metafenoma). [18] [10]
En este modelo, las actividades metabólicas microbianas para la renovación del carbono se dividen en dos categorías: modificación ex vivo, que se refiere a la transformación del carbono derivado de las plantas por enzimas extracelulares, y renovación in vivo, para el carbono intracelular utilizado en la renovación de la biomasa microbiana o depositado como biomasa microbiana muerta, denominada necromasa. Los impactos contrastantes de las actividades catabólicas que liberan carbono orgánico del suelo como dióxido de carbono (CO2 ) , frente a las vías anabólicas que producen compuestos de carbono estables, controlan las tasas netas de retención de carbono. En particular, el secuestro de carbono microbiano representa un aspecto subrepresentado del flujo de carbono del suelo que el modelo de bomba de carbono microbiano intenta abordar. [17] Un área relacionada de incertidumbre es cómo el tipo de carbono derivado de las plantas mejora el almacenamiento de carbono orgánico del suelo microbiano o, alternativamente, acelera la descomposición del carbono orgánico del suelo. [19] Por ejemplo, la hojarasca y la hojarasca de acículas sirven como fuentes de carbono para el crecimiento microbiano en los suelos forestales, pero la química de la hojarasca y el pH varían según el tipo de vegetación [por ejemplo, entre la hojarasca de raíces y la hojarasca foliar [20] o entre la hojarasca de bosques caducifolios y coníferos (14)]. A su vez, estas diferencias bioquímicas influyen en los niveles de carbono orgánico del suelo a través de cambios en la dinámica de descomposición. [21] Además, una mayor diversidad de comunidades vegetales aumenta las tasas de rizodeposición, estimulando la actividad microbiana y el almacenamiento de carbono orgánico del suelo, [22] aunque los suelos eventualmente alcanzan un punto de saturación más allá del cual no pueden almacenar carbono adicional. [23] [10]