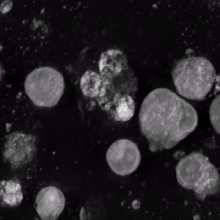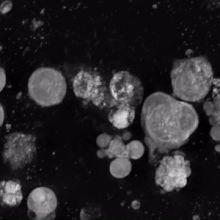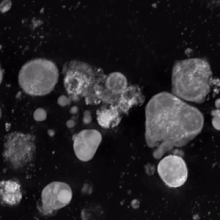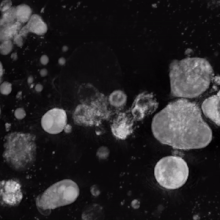
Un megacariocito ( mega- + cario- + -cito , "célula de núcleo grande") es una célula grande de la médula ósea con un núcleo lobulado que produce plaquetas sanguíneas (trombocitos), que son necesarias para la coagulación normal . En los seres humanos, los megacariocitos suelen representar 1 de cada 10.000 células de la médula ósea , pero su número puede aumentar casi diez veces durante el curso de determinadas enfermedades. [1] Debido a las variaciones en la combinación de formas y ortografía, los sinónimos incluyen megalocariocito y megacariocito .
En general, los megacariocitos son de 10 a 15 veces más grandes que un glóbulo rojo típico, con un diámetro promedio de 50 a 100 μm. Durante su maduración, el megacariocito crece de tamaño y replica su ADN sin citocinesis en un proceso llamado endomitosis . Como resultado, el núcleo del megacariocito puede volverse muy grande y lobulado, lo que, bajo un microscopio óptico, puede dar la falsa impresión de que hay varios núcleos. En algunos casos, el núcleo puede contener hasta 64 N de ADN, o 32 copias del complemento normal de ADN en una célula humana.
El citoplasma , al igual que las plaquetas que brotan de él, contiene gránulos α y cuerpos densos .

Los megacariocitos se derivan de células precursoras de células madre hematopoyéticas en la médula ósea. Son producidos principalmente por el hígado, el riñón, el bazo y la médula ósea. Estas células madre multipotentes viven en los sinusoides de la médula y son capaces de producir todo tipo de células sanguíneas en función de las señales que reciben. La señal principal para la producción de megacariocitos es la trombopoyetina o TPO. La TPO es suficiente pero no absolutamente necesaria [2] para inducir la diferenciación de células progenitoras en la médula ósea hacia un fenotipo de megacariocito final . Otras señales moleculares para la diferenciación de megacariocitos incluyen GM-CSF , IL-3 , IL-6 , IL-11 , quimiocinas ( SDF-1 , FGF-4 ), [3] y eritropoyetina . [4] El megacariocito se desarrolla a través del siguiente linaje:
CFU-Me ( célula madre hematopoyética pluripotencial o hemocitoblasto) → megacarioblasto → promegacariocito → megacariocito.
La célula eventualmente alcanza la etapa de megacariocito y pierde su capacidad de dividirse. Sin embargo, todavía es capaz de replicar su ADN y continuar desarrollándose, volviéndose poliploide . [4] El citoplasma continúa expandiéndose y la cantidad de ADN puede aumentar hasta 64n en humanos y 256n en ratones. Muchas de las características morfológicas de la diferenciación de megacariocitos pueden recapitularse en células no hematopoyéticas mediante la expresión de β-tubulina de clase VI (β6) y proporcionan una base mecanicista para comprender estos cambios. [5]
Una vez que la célula ha completado la diferenciación y se ha convertido en un megacariocito maduro, comienza el proceso de producción de plaquetas. El proceso de maduración se produce mediante replicación endomitótica sincrónica mediante la cual el volumen citoplasmático aumenta a medida que el número de cromosomas se multiplica sin división celular. La célula cesa su crecimiento a 4N, 8N o 16N, se vuelve granular y comienza a producir plaquetas. [6] La trombopoyetina desempeña un papel en la inducción de los megacariocitos para formar pequeños procesos protoplaquetarios. Las plaquetas se encuentran dentro de estas membranas internas dentro del citoplasma de los megacariocitos. Hay dos mecanismos propuestos para la liberación de plaquetas. En un escenario, estos procesos protoplaquetarios se rompen explosivamente para convertirse en plaquetas. [7] Es posible visualizar la liberación espontánea de plaquetas mediante imágenes holotomográficas de células vivas . Alternativamente, la célula puede formar cintas de plaquetas en los vasos sanguíneos. Las cintas se forman a través de pseudópodos y pueden emitir plaquetas de forma continua a la circulación. En cualquier escenario, cada uno de estos procesos protoplaquetarios puede dar lugar a entre 2.000 y 5.000 nuevas plaquetas tras su descomposición. En total, 2/3 de estas plaquetas recién producidas permanecerán en circulación, mientras que 1/3 será secuestrada por el bazo. [ cita médica necesaria ]
La trombopoyetina (TPO) es una proteína de 353 aminoácidos codificada en el cromosoma 3p 27. La TPO se sintetiza principalmente en el hígado [8] , pero puede producirse en los riñones, los testículos, el cerebro e incluso las células del estroma de la médula ósea. Tiene alta homología con la eritropoyetina . Es fundamental para la formación de una cantidad adecuada de plaquetas.
Después de la brotación de las plaquetas, lo que queda es principalmente el núcleo celular. Éste cruza la barrera de la médula ósea hacia la sangre y es consumido en los pulmones por los macrófagos alveolares .
Las citoquinas son señales utilizadas en el sistema inmunológico para la comunicación intercelular. Hay muchas citocinas que afectan a los megacariocitos. Ciertas citoquinas como IL-3 , IL-6 , IL-11 , LIF , eritropoyetina y trombopoyetina estimulan la maduración de las células progenitoras megacariocíticas. [9] Otras señales como PF4 , CXCL5 , CXCL7 y CCL5 inhiben la formación de plaquetas. [10]
Los megacariocitos son directamente responsables de producir plaquetas, que son necesarias para la formación de un trombo o coágulo de sangre. Hay varias enfermedades que son directamente atribuibles a la función anormal de los megacariocitos o a la función plaquetaria anormal. [11]
La trombocitemia esencial (TE) es un trastorno caracterizado por un número elevado de plaquetas circulantes. La enfermedad ocurre en 1 a 2 por cada 100.000 personas. Los requisitos de la OMS para el diagnóstico de 2016 incluyen > 450 000 plaquetas/μL de sangre (normal 150 000 a 400 000) y hallazgos característicos en una biopsia de médula ósea . Algunas de las consecuencias de tener un número tan elevado de plaquetas incluyen trombosis o coágulos en los vasos sanguíneos. Los trombos se forman con más frecuencia en las arterias que en las venas. Parece irónico que tener recuentos de plaquetas superiores a 1.000.000 de plaquetas/μl pueda provocar episodios hemorrágicos . [12] Aproximadamente la mitad de los casos de ET se deben a una mutación en la proteína JAK2 , un miembro de la vía de señalización JAK-STAT . [13] Esta mutación induce una señal proliferativa no regulada del receptor de trombopoyetina (TPO) en ausencia de TPO, lo que provoca la expansión clonal de las células de la médula ósea, especialmente los megacariocitos. Existe un bajo riesgo de transformación a leucemia con este trastorno. El tratamiento primario consiste en anagrelida o hidroxiurea para reducir los niveles de plaquetas.
La trombocitopenia amegacariocítica congénita (CAMT) es un trastorno hereditario poco común . Las manifestaciones primarias son la trombocitopenia y la megacariocitopenia, es decir, un número bajo de plaquetas y megacariocitos. Hay ausencia de megacariocitos en la médula ósea sin anomalías físicas asociadas. [14] La causa de este trastorno parece ser una mutación en el gen del receptor de TPO, c-mpl , a pesar de los altos niveles de TPO en suero. [15] [16] Además, puede haber anomalías en el sistema nervioso central, incluidos el cerebro y el cerebelo , que podrían causar síntomas. [15] El tratamiento principal para la CAMT es el trasplante de médula ósea .
El trasplante de médula ósea/células madre es el único remedio para esta enfermedad genética. Se requieren transfusiones frecuentes de plaquetas para evitar que el paciente muera desangrado hasta que se haya completado el trasplante, aunque no siempre es así.
No parece haber ningún recurso genérico para pacientes CAMT en la web y esto se debe potencialmente a la rareza de la enfermedad.
En 1906, James Homer Wright proporcionó pruebas de que los megacariocitos dan origen a las plaquetas sanguíneas. [17]
Kelemen acuñó por primera vez el término " trombopoyetina " para describir la sustancia humoral responsable de la producción de plaquetas. [18]