En física atómica , un número cuántico magnético es un número cuántico utilizado para distinguir los estados cuánticos de un electrón u otra partícula según su momento angular a lo largo de un eje determinado en el espacio. El número cuántico magnético orbital ( m l o m [a] ) distingue los orbitales disponibles dentro de una subcapa determinada de un átomo. Especifica el componente del momento angular orbital que se encuentra a lo largo de un eje dado, convencionalmente llamado eje z , por lo que describe la orientación del orbital en el espacio. El número cuántico magnético de espín m s especifica el componente del eje z del momento angular de espín para una partícula que tiene un número cuántico de espín s . Para un electrón, s es 1 ⁄ 2 y m s es + 1 ⁄ 2 o − 1 ⁄ 2 , a menudo llamados "giro hacia arriba" y "giro hacia abajo", o α y β. [1] [2] El término magnético en el nombre se refiere al momento dipolar magnético asociado con cada tipo de momento angular, por lo que los estados que tienen diferentes números cuánticos magnéticos cambian de energía en un campo magnético de acuerdo con el efecto Zeeman . [2]
Los cuatro números cuánticos utilizados convencionalmente para describir el estado cuántico de un electrón en un átomo son el número cuántico principal n , el número cuántico azimutal (orbital) y los números cuánticos magnéticos m l y m s . Los electrones en una subcapa determinada de un átomo (como s, p, d o f) se definen por valores de (0, 1, 2 o 3). El número cuántico magnético orbital toma valores enteros en el rango de a , incluido el cero. [3] Así, las subcapas s, p, d y f contienen 1, 3, 5 y 7 orbitales cada una. Cada uno de estos orbitales puede albergar hasta dos electrones (con espines opuestos), formando la base de la tabla periódica .
Otros números cuánticos magnéticos se definen de manera similar, como m j para el componente del eje z , el momento angular electrónico total j , [1] y m I para el espín nuclear I. [2] Los números cuánticos magnéticos se escriben con mayúscula para indicar los totales de un sistema de partículas, como M L o m L para el momento angular orbital total del eje z de todos los electrones de un átomo. [2]
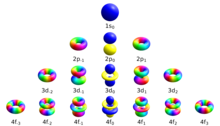
Existe un conjunto de números cuánticos asociados a los estados energéticos del átomo. Los cuatro números cuánticos , , y especifican el estado cuántico completo de un solo electrón en un átomo llamado función de onda u orbital . La ecuación de Schrödinger para la función de onda de un átomo con un electrón es una ecuación diferencial parcial separable . (Este no es el caso del átomo de helio neutro u otros átomos con electrones que interactúan entre sí, que requieren métodos más sofisticados para la solución [4] ). Esto significa que la función de onda expresada en coordenadas esféricas se puede descomponer en el producto de tres funciones. del radio, ángulo de colatitud (o polar) y azimut: [5]
La ecuación diferencial de se puede resolver en la forma . Debido a que los valores del ángulo de azimut que difieren en 2 radianes (360 grados) representan la misma posición en el espacio, y la magnitud general de no crece arbitrariamente como lo haría con un exponente real, el coeficiente debe cuantificarse en múltiplos enteros de , produciendo un exponente imaginario : . [6] Estos números enteros son los números cuánticos magnéticos. La misma constante aparece en la ecuación de colatitud, donde valores mayores de tienden a disminuir la magnitud de y valores mayores que el número cuántico azimutal no permiten ninguna solución para
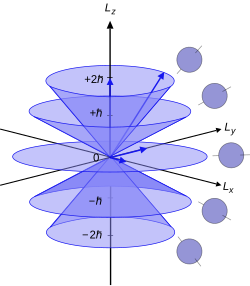
El eje utilizado para las coordenadas polares en este análisis se elige arbitrariamente. El número cuántico se refiere a la proyección del momento angular en esta dirección elegida arbitrariamente, convencionalmente llamada dirección -o eje de cuantificación. , la magnitud del momento angular en la dirección - viene dada por la fórmula: [7]
Este es un componente del momento angular orbital total del electrón atómico , cuya magnitud está relacionada con el número cuántico azimutal de su subcapa mediante la ecuación:
donde es la constante de Planck reducida . Tenga en cuenta que esto es aproximado para alto . No es posible medir el momento angular del electrón a lo largo de los tres ejes simultáneamente. Estas propiedades fueron demostradas por primera vez en el experimento de Stern-Gerlach , realizado por Otto Stern y Walther Gerlach . [8]
El número cuántico se refiere, en términos generales, a la dirección del vector del momento angular . El número cuántico magnético sólo afecta a la energía del electrón si se encuentra en un campo magnético porque en ausencia de uno, todos los armónicos esféricos correspondientes a los diferentes valores arbitrarios de son equivalentes. El número cuántico magnético determina el desplazamiento de energía de un orbital atómico debido a un campo magnético externo (el efecto Zeeman ), de ahí el nombre de número cuántico magnético . Sin embargo, el momento dipolar magnético real de un electrón en un orbital atómico surge no sólo del momento angular del electrón sino también del espín del electrón, expresado en el número cuántico de espín .
Dado que cada electrón tiene un momento magnético en un campo magnético, estará sujeto a un par que tiende a hacer que el vector sea paralelo al campo, fenómeno conocido como precesión de Larmor .