En química supramolecular , [1] la química anfitrión-huésped describe complejos que están compuestos de dos o más moléculas o iones que se mantienen unidos en relaciones estructurales únicas por fuerzas distintas a las de los enlaces covalentes completos . La química anfitrión-huésped abarca la idea de reconocimiento molecular e interacciones a través de enlaces no covalentes . Los enlaces no covalentes son fundamentales para mantener la estructura 3D de moléculas grandes, como las proteínas, y están involucrados en muchos procesos biológicos en los que las moléculas grandes se unen específicamente pero transitoriamente entre sí.
Aunque las interacciones no covalentes podrían dividirse aproximadamente en aquellas con contribuciones más electrostáticas o dispersivas, hay algunos tipos de interacciones no covalentes que se mencionan comúnmente: enlace iónico , enlace de hidrógeno , fuerzas de van der Waals e interacciones hidrofóbicas . [2]
La interacción anfitrión-huésped ha despertado una gran atención desde que se descubrió. Es un campo importante, porque muchos procesos biológicos requieren la interacción anfitrión-huésped, y puede ser útil en algunos diseños de materiales. Hay varias moléculas anfitrionas típicas, como la ciclodextrina, el éter corona , etc.


Las "moléculas anfitrionas" suelen tener una estructura "similar a un poro" que les permite capturar una "molécula huésped". Aunque se les llama moléculas, los anfitriones y los huéspedes suelen ser iones. Las fuerzas impulsoras de la interacción pueden variar, como el efecto hidrofóbico y las fuerzas de van der Waals [5] [5] [6] [7] [8]
La unión entre el anfitrión y el huésped puede ser muy selectiva, en cuyo caso la interacción se denomina reconocimiento molecular . A menudo, existe un equilibrio dinámico entre los estados unidos y no unidos:
El componente "anfitrión" es a menudo la molécula más grande y encierra a la molécula más pequeña, "huésped". En los sistemas biológicos, los términos análogos de anfitrión y huésped se denominan comúnmente enzima y sustrato respectivamente. [9]
Los compuestos de inclusión (también conocidos como complejos de inclusión ) están estrechamente relacionados con la química anfitrión-huésped . En este caso, se trata de un complejo químico en el que un compuesto químico (el "anfitrión") tiene una cavidad en la que se puede alojar un compuesto "huésped". La interacción entre el anfitrión y el huésped implica puramente enlaces de van der Waals . La definición de compuestos de inclusión es muy amplia y se extiende a los canales formados entre moléculas en una red cristalina en la que pueden encajar las moléculas del huésped.
Compuesto de inclusión : Complejo en el que un componente (el huésped) forma una cavidad o, en el caso de un cristal, una red cristalina que contiene espacios en forma de túneles o canales largos en los que se encuentran las entidades moleculares de una segunda especie química (el huésped). No existe enlace covalente entre el huésped y el anfitrión, ya que la atracción se debe generalmente a fuerzas de van der Waals. [10]
Los calixarenos y los condensados de formaldehído-areno relacionados son una clase de anfitriones que forman compuestos de inclusión. Un ejemplo famoso es el aducto con ciclobutadieno , que de otro modo sería inestable. [11]
Las ciclodextrinas (CD) son moléculas tubulares compuestas de varias unidades de glucosa conectadas por enlaces éter. Los tres tipos de CD, α-CD (6 unidades), β-CD (7 unidades) y γ-CD (8 unidades) difieren en el tamaño de sus cavidades: 5, 6 y 8 Å, respectivamente. La α-CD puede unirse a una cadena de PEG, mientras que la γ-CD puede unirse a dos cadenas de PEG. La β-CD puede unirse a una molécula basada en tiofeno. [5]
Las ciclodextrinas son huéspedes bien establecidos para la formación de compuestos de inclusión. [1] [2] [3] Un ejemplo ilustrativo es el caso del ferroceno que se inserta en la ciclodextrina a 100 °C en condiciones hidrotermales. [12]
La ciclodextrina también forma compuestos de inclusión con fragancias . Como resultado, las moléculas de fragancia tienen una presión de vapor reducida y son más estables frente a la exposición a la luz y al aire. Cuando se incorpora a los textiles, la fragancia dura mucho más debido a la acción de liberación lenta . [13]

La estructura de los criptofanos contiene 6 anillos de fenilo, conectados principalmente de 4 maneras. Debido a los grupos fenilo y las cadenas alifáticas, las jaulas dentro de los criptofanos son altamente hidrofóbicas, lo que sugiere la capacidad de capturar moléculas no polares. En base a esto, los criptofanos pueden emplearse para capturar xenón en solución acuosa, lo que podría ser útil en estudios biológicos. [5]
A continuación se muestra una de las estructuras clásicas de los resorcinarenos y pirogalolarenos . Debido al grupo fenol, se forman algunos enlaces de hidrógeno entre las moléculas. A veces, la relación de unión del anfitrión y el huésped puede alcanzar 2:1. [5] Los cucurbit[n]urilos tienen un tamaño similar de γ-CD, que también se comportan de manera similar ( por ejemplo , 1 cucurbit[n]urilo puede enroscarse en 2 cadenas de PEG). [5]

Los éteres corona se unen a los cationes. Los éteres corona pequeños, por ejemplo, 12-corona-4 se unen bien a iones pequeños como Li+ y las coronas grandes, como 24-corona-8 se unen mejor a iones más grandes. [5] Además de unirse a huéspedes iónicos, los éteres corona también se unen a algunas moléculas neutras, por ejemplo , 1, 2, 3-triazol. Los éteres corona también pueden enhebrarse con moléculas lineales delgadas y/o polímeros, dando lugar a estructuras supramoleculares llamadas rotaxanos . Dado que los éteres corona no están unidos a las cadenas, pueden moverse hacia arriba y hacia abajo en la molécula de enhebrado. [8] Los complejos de éter corona de cationes metálicos (y los complejos correspondientes de Cryptands ) no se consideran complejos de inclusión ya que el huésped está unido por fuerzas más fuertes que el enlace de van der Waals.
Cuando las moléculas anfitrionas y huéspedes se combinan para formar un único complejo, el equilibrio se representa como
y la constante de equilibrio, K, se define como
donde [X] denota la concentración de una especie química X (se supone que todos los coeficientes de actividad tienen un valor numérico de 1). Las ecuaciones de balance de masa, en cualquier punto de datos,
donde y representan las concentraciones totales del anfitrión y del huésped, se pueden reducir a una única ecuación cuadrática en, digamos, [G] y por lo tanto se pueden resolver analíticamente para cualquier valor dado de K. Luego se pueden derivar las concentraciones [H] y [HG].
El siguiente paso en el cálculo es calcular el valor, , de una cantidad correspondiente a la cantidad observada . Luego, una suma de cuadrados, U, sobre todos los puntos de datos, np, se puede definir como
y esto puede minimizarse con respecto al valor de la constante de estabilidad, K, y un parámetro como el desplazamiento químico de la especie HG (datos de RMN) o su absorbancia molar (datos de UV/VIS). Este procedimiento es aplicable a aductos 1:1.

En los espectros de resonancia magnética nuclear (RMN), el valor del desplazamiento químico observado , δ , que surge de un átomo determinado contenido en una molécula de reactivo y uno o más complejos de ese reactivo, será el promedio ponderado por la concentración de todos los desplazamientos de esas especies químicas. Se supone que el intercambio químico es rápido en la escala de tiempo de RMN.
Utilizando espectroscopia UV-vis, la absorbancia de cada especie es proporcional a la concentración de esa especie, según la ley de Beer-Lambert .
donde λ es una longitud de onda, es la longitud del camino óptico de la cubeta que contiene la solución de los N compuestos ( cromóforos ), es la absorbancia molar (también conocida como coeficiente de extinción) de la i ésima especie química en la longitud de onda λ, c i es su concentración. Cuando las concentraciones se han calculado como se indicó anteriormente y se ha medido la absorbancia para muestras con diversas concentraciones de anfitrión y huésped, la ley de Beer-Lambert proporciona un conjunto de ecuaciones, en una longitud de onda dada, que se pueden resolver mediante un proceso de mínimos cuadrados lineales para los valores desconocidos del coeficiente de extinción en esa longitud de onda.
Otras técnicas incluyen la intensidad fluorescente y la calorimetría.
La formación de complejos huésped-huésped es una práctica generalizada en bioquímica. Muchos hospedadores proteínicos reconocen y, por lo tanto, se unen selectivamente a otras biomoléculas. Cuando el hospedador proteínico es una enzima, los hospedadores se denominan sustratos. Si bien estos conceptos están bien establecidos en los sistemas biológicos, las aplicaciones de la química huésped-huésped sintética siguen siendo, en su mayoría, del ámbito de las aspiraciones. Una excepción importante son las zeolitas, donde la química huésped-huésped es su razón de ser.

Un hidrogel autorreparador construido a partir de ciclodextrina modificada y adamantano. [14] [16] Otra estrategia es utilizar la interacción entre la estructura principal del polímero y la molécula huésped (la molécula huésped se enrosca sobre el polímero). Si el proceso de enroscado es lo suficientemente rápido, también se puede lograr la autorreparación. [15]
Las estructuras de anfitrión-huésped pueden proporcionar una matriz rígida que protege a los emisores de ser apagados, extendiendo la vida útil de la fosforescencia. [17] En esta circunstancia, se podrían utilizar α-CD y CB, [18] [19] en los que el fósforo sirve como huésped para interactuar con el anfitrión. Por ejemplo, los derivados de 4-fenilpiridio interactuaron con CB y se copolimerizaron con acrilamida . El polímero resultante produjo ~2 s de vida útil de fosforescencia. Además, Zhu et al utilizaron éter corona e ión potasio para modificar el polímero y mejorar la emisión de fosforescencia. [20]
Muchas moléculas huésped son fotosensibles. [21]
Un sistema de cifrado construido por pillar[5]areno, espiropirano y pentanonitrilo (estado libre e injertado al polímero) fue construido por Wang et al . Después de la irradiación UV, el espiropirano se transformaría en merocianina. Cuando la luz visible se dirigió al material, la merocianina cercana al complejo de pentanonitrilo libre de pillar[5]areno tuvo una transformación más rápida en espiropirano; por el contrario, la cercana al complejo de pentanonitrilo injertado con pillar[5]areno tiene una tasa de transformación mucho más lenta. Esta transformación de espiropirano-merocianina se puede utilizar para el cifrado de mensajes. [22] Otra estrategia se basa en los encapsulados metálicos y los hidrocarburos aromáticos policíclicos. [23] Debido a las diferencias de emisión de fluorescencia entre el complejo y las jaulas, la información podría cifrarse.
Aunque algunas interacciones anfitrión-huésped no son fuertes, aumentar la cantidad de interacción anfitrión-huésped puede mejorar las propiedades mecánicas de los materiales. Por ejemplo, enhebrar las moléculas del anfitrión sobre el polímero es una de las estrategias comúnmente utilizadas para aumentar las propiedades mecánicas del polímero. Las moléculas del anfitrión tardan un tiempo en desenhebrarse del polímero, lo que puede ser una forma de disipación de energía. [16] [24] [25] Otro método es utilizar la interacción anfitrión-huésped de intercambio lento. Aunque el intercambio lento mejora las propiedades mecánicas, al mismo tiempo, se sacrifican las propiedades de autocuración. [26]
Tradicionalmente, la detección química se ha abordado con un sistema que contiene un indicador unido covalentemente a un receptor a través de un conector. Una vez que el analito se une, el indicador cambia de color o emite fluorescencia. Esta técnica se denomina método indicador-espaciador-receptor (ISR). [27] A diferencia del ISR, el ensayo de desplazamiento del indicador (IDA) utiliza una interacción no covalente entre un receptor (el anfitrión), un indicador y un analito (el huésped). De manera similar al ISR, el IDA también utiliza indicadores colorimétricos (C-IDA) y de fluorescencia (F-IDA). En un ensayo IDA, se incuba un receptor con el indicador. Cuando se agrega el analito a la mezcla, el indicador se libera al medio ambiente. Una vez que se libera el indicador, cambia de color (C-IDA) o emite fluorescencia (F-IDA). [28]
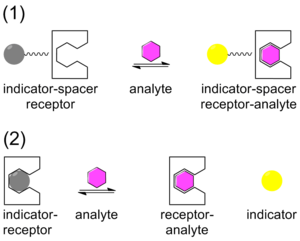
La IDA ofrece varias ventajas en comparación con el método tradicional de detección química ISR. En primer lugar, no requiere que el indicador esté unido covalentemente al receptor. En segundo lugar, dado que no hay enlace covalente, se pueden utilizar varios indicadores con el mismo receptor. Por último, los medios en los que se puede utilizar el ensayo son diversos. [29]

Las técnicas de detección química como la C-IDA tienen implicaciones biológicas. Por ejemplo, la protamina es un coagulante que se administra rutinariamente después de la cirugía cardiopulmonar que contrarresta la actividad anticoagulante de la herapína. Para cuantificar la protamina en muestras de plasma, se utiliza un ensayo de desplazamiento colorimétrico. El colorante Azure A es azul cuando no está unido, pero cuando está unido a la herapína, muestra un color púrpura. La unión entre Azure A y la heparina es débil y reversible. Esto permite que la protamina desplace a Azure A. Una vez que se libera el colorante, muestra un color púrpura. El grado en que se desplaza el colorante es proporcional a la cantidad de protamina en el plasma. [30]
Kwalczykowski y sus colaboradores han utilizado F-IDA para controlar las actividades de la helicasa en E. coli . En este estudio, utilizaron naranja de tiazol como indicador. La helicasa desenrolla el dsADN para formar ssADN. La intensidad de fluorescencia de la naranja de tiazol tiene una mayor afinidad por el dsADN que por el ssADN y su intensidad de fluorescencia aumenta cuando está unido al dsADN que cuando no está unido. [31] [32]
Tradicionalmente, se ha considerado a un sólido cristalino como una entidad estática en la que los movimientos de sus componentes atómicos están limitados a su equilibrio vibracional. Como se ha visto en la transformación del grafito en diamante, la transformación de sólido a sólido puede ocurrir bajo presión física o química. Se ha propuesto que la transformación de una disposición cristalina a otra ocurre de manera cooperativa. [33] [34] La mayoría de estos estudios se han centrado en estudiar una estructura orgánica o metalorgánica. [35] [36] Además de los estudios de transformación cristalina macromolecular, también hay estudios de moléculas monocristalinas que pueden cambiar su conformación en presencia de disolventes orgánicos. Se ha demostrado que un complejo organometálico se transforma en varias orientaciones dependiendo de si está expuesto a vapores de disolventes o no. [37]
Se han propuesto sistemas de hospedaje para eliminar materiales peligrosos. Ciertos calix[4]arenos se unen a iones de cesio-137, lo que en principio podría aplicarse para limpiar desechos radiactivos. Algunos receptores se unen a carcinógenos. [38] [39]
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: otros ( enlace )